Elektrokemijske celice

- 3407
- 395
- Lee Farrell
Kaj so elektrokemijske celice?
The Elektrokemijske celice So naprave, v katerih kemične reakcije prehajajo, kjer se kemična energija pretvori v elektriko ali obratno. Te celice sestavljajo srce elektrokemije, duša pa je potencialna izmenjava elektronov, ki se lahko med dvema kemijskima vrstama pojavijo, spontano ali ne spontano.
Ena od obeh vrst oksidira, izgubi elektrone, druga. Običajno je vrsta, ki je zmanjšana. Po drugi strani pa vrsta, ki oksidira, kovina in postanejo kovinski kationi.
 Danielov diagram elektrokemičnih celic. Vir: Rechua [cc by (https: // createCommons.Org/licence/by/3.0)]
Danielov diagram elektrokemičnih celic. Vir: Rechua [cc by (https: // createCommons.Org/licence/by/3.0)] Na primer, nadrejena slika predstavlja Danielovo celico: najpreprostejša od vseh elektrokemijskih celic. Kovinska cinkova elektroda je oksidirana in sprošča katione Zn2+ v vodno okolje. To se zgodi v posodi ZnSO4 z leve strani.
Na desni strani, ki vsebuje cuo4 Zmanjša se, preoblikuje katione Cu2+ V kovinskem bakra, ki je nanesena na bakreno elektrodo. Med razvojem te reakcije elektroni potujejo z zunanjim vezjem, ki aktivira svoje mehanizme; In zato zagotavljanje električne energije za delovanje opreme.
Komponente elektrokemijskih celic
Elektrode
V elektrokemičnih celicah se ustvarijo ali porabijo. Za zagotovitev pravilnega pretoka elektronov morajo biti materiali, ki so dobri električni vodniki. Tu prihajajo elektrode in zunanje vezje, ki so opremljene z bakrenim ožičenjem, srebrom ali zlatom.
Elektrode so materiali, ki zagotavljajo površino, kjer bodo razvite reakcije v elektrokemičnih celicah. Obstajata dve vrsti glede na reakcijo, ki se pojavlja v njih:
- Anoda, elektroda, kjer se pojavi oksidacija.
- Katoda, elektroda, kjer se zgodi znižanje.
Elektrode so lahko izdelane iz reakcijskega materiala, kot v primeru Danielove celice (cink in baker); ali, inertnega materiala, kot je to, če so narejeni iz platine ali grafita.
Elektroni, ki jih dodeli anoda, morajo doseči katodo; Vendar ne skozi rešitev, ampak potujte kovinski kabel, ki se pridruži obema elektrodama do zunanjega vezja.
Raztapljanje elektrolitov
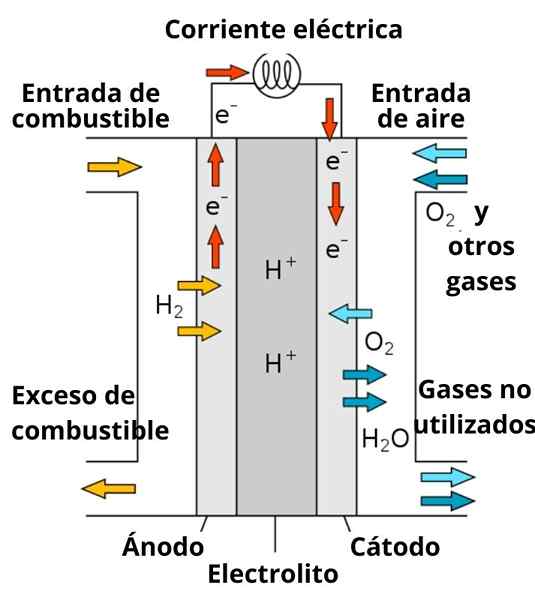 Shema protonske baterije za prevodno gorivo
Shema protonske baterije za prevodno gorivo Tudi raztapljanje, ki obdaja elektrode, ima pomembno vlogo, saj je obogatena z močnimi elektroliti; kot je: kcl, kno3, NaCl itd. Ti ioni do neke mere dajejo migracijo elektronov iz anode na katodo, pa tudi njihovo prevodnost v bližini elektrod za interakcijo z vrstami, da se zmanjša.
Morska voda na primer vodi veliko boljšo elektriko kot destilirana voda, z nižjo koncentracijo ionov. Zato imajo elektrokemične celice raztopino močnih elektrolitov med njihovimi sestavnimi deli.
Slani most
Ioni raztopine začnejo obkrožati elektrode, kar povzroča polarizacijo obremenitev. Razpad okoli katode se začne polniti negativno, saj se kationi zmanjšujejo; V primeru Danielove celice, Cu Cations2+ Z odlaganjem kot kovinski baker na katodi. Tako obstaja primanjkljaj pozitivnih nabojev.
Tukaj posega v fiziološki most, da uravnoteži obremenitve in prepreči polariziranje elektrod. Na stran ali predal katodnih kationov fiziološkega mostu se bo preselil, bodisi k+ ali Zn2+, Za nadomeščanje CU2+ porabljeni. Medtem bo iz slane mostu selilo anione ne3- Proti anodnemu predelu, za nevtralizacijo naraščajoče koncentracije kationov Zn2+.
Lahko vam služi: kalijev dihromro: formula, lastnosti, tveganja in uporabeSlani most je sestavljen iz raztopine nasičenih soli, z njenimi konci, pokriti s prepustnim ionskim gelom, vendar vodoodporen za vodo.
Vrste elektrokemijskih celic in kako delujejo
Način, kako deluje elektrokemična celica, je odvisen od vrste, ki je. V bistvu obstajata dve vrsti: galvanski (ali voltaični) in elektrolitski
Galvanike
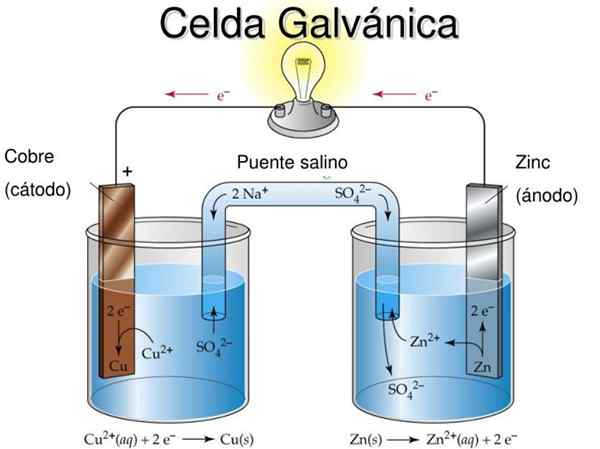
Danielova celica je primer galvanske elektrokemijske celice. V njih se reakcije pojavljajo spontano in potencial baterije je pozitiven; Večji kot je potencial, večja je elektrika, ki bo oskrbovala celico.
Baterije ali baterije so natančno galvanske celice: Kemični potencial med obema elektrodama se pretvori v električno energijo, ko se zunanje vezje vmeša. Tako se elektroni selijo iz anode, prižgejo opremo, na katero je priključena baterija, in se vrnejo neposredno v katodo.
Elektrolitično
Elektrolitične celice so tiste, katerih reakcije se ne pojavljajo spontano, razen če jih električna energija oskrbuje iz zunanjega vira. Tu se pojavi nasprotni pojav: elektrika omogoča razvijanje ne -spontanih kemičnih reakcij.
Ena najbolj znanih in dragocenih reakcij, ki poteka v tej vrsti celice, je elektroliza.
Popolnitvene baterije so primeri elektrolitskih in hkrati galvanskih: napolni so, da obrnejo svoje kemijske reakcije in ponovno vzpostavijo začetne pogoje, da ponovno uporabijo ponovno uporabo.
Primeri
Danielova celica
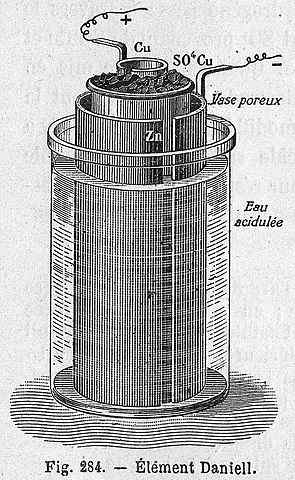 Danielova celična shema
Danielova celična shema Naslednja kemična enačba ustreza reakciji Danielove celice, kjer sodelujeta cink in baker:
Vam lahko služi: najem halogenuros: nepremičnine, pridobivanje, primeriZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Toda Cu Cations2+ in Zn2+ Niso sami, vendar jih spremljajo tako anioni42-. Ta celica je lahko predstavljena na naslednji način:
Zn | Znso4 | | Cuso4 | Cu
Danielovo celico je mogoče zgraditi v katerem koli laboratoriju, saj se zelo ponavlja kot praksa pri uvedbi elektrokemije. Kot cu2+ Odločena je kot Cu, modra barva raztopine CUSO4 Izgubljeno bo.
Platinasta in vodikova celica
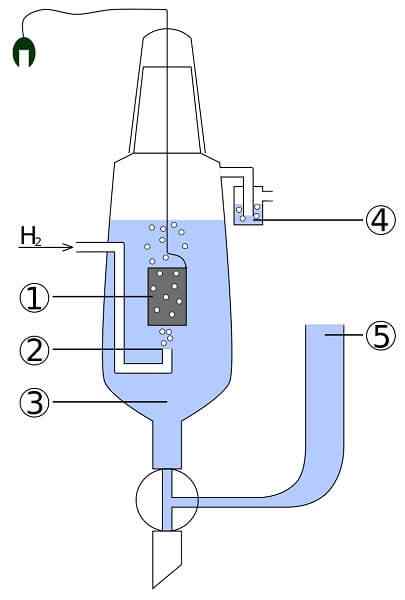 Shema platine in vodikove celice: 1. 2 platinasta elektroda. Vodikov plin 3. Kislinska raztopina 4. Hidroseal 5. Depozit
Shema platine in vodikove celice: 1. 2 platinasta elektroda. Vodikov plin 3. Kislinska raztopina 4. Hidroseal 5. Depozit Predstavljajte si celico, ki zaužije plinasti vodik, proizvaja kovinsko srebro in hkrati pa je potrebna za elektriko. To je platinasta in vodikova celica, njegova splošna reakcija pa je naslednja:
2agcl (s) + h2(g) → 2Ag (s) + 2H+ + 2Cl-
Tu v prostoru anode imamo inertno platinsko elektrodo, potopljeno v vodo in na katero se črpa vodik. H2 Oksidirajte na H+ in prinaša svoje elektrone na Mlečni oborini AgCl v katodni predel s kovinsko srebrno elektrodo. AGCL se bo zmanjšal na tem srebru in testo z elektrodo se bo povečalo.
Ta celica je lahko predstavljena kot:
Pt, h2 | H+ | | Cl-, Agcl | Ag
Downsova celica
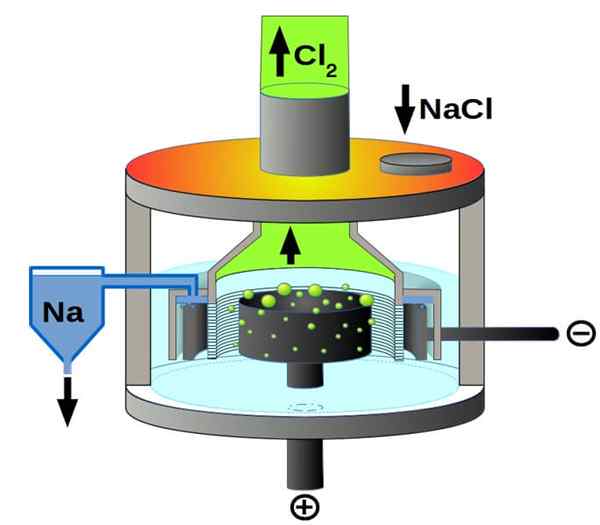 Downs celična shema za elektrolizo natrijevega klorida. Vir: Pchemiker, CC BY-SA 4.0, prek Wikimedia Commons
Downs celična shema za elektrolizo natrijevega klorida. Vir: Pchemiker, CC BY-SA 4.0, prek Wikimedia Commons In končno, med elektrolitičnimi celicami imamo staljeni natrijev klorid, bolj znan kot Downs Cell. Tu je električna energija potuje po elektrodah volumen staljenega NaCl in tako izvira iz njih naslednje reakcije:
2. mesto+(l) + 2e- → 2na (s) (katoda)
2Cl-(L) → cl2(g) + 2e- (anoda)
2nacl (l) → 2na (s) + Cl2(g) (globalna reakcija)
Tako lahko pripravite zahvaljujoč električni energiji in natrijevem kloridu, kovinskem natriju in kloru.

