Deli galvanskih celic, kako deluje, aplikacije, primeri

- 1463
- 451
- Percy Feeney
The Galvanska celica O voltaična celica je vrsta elektrokemijske celice, ki je sestavljena iz dveh različnih kovin, potopljenih v dve polladi, v katerih je spojina v aktivni raztopini spontana reakcija.
Nato se ena od kovin v enem od pol -oltov oksidira, medtem ko se kovina drugega pol -media zmanjša, kar povzroči izmenjavo elektronov skozi zunanje vezje. To omogoča izkoriščanje električnega toka.
 Slika 1. Shema in deli galvanske celice. Vir: Korint.Pucp.Edu.pe.
Slika 1. Shema in deli galvanske celice. Vir: Korint.Pucp.Edu.pe. Ime "Galvanska celica" je v čast ene od pionirjev eksperimentiranja z elektriko: italijanski zdravnik in fiziolog Luigi Galvani (1737-1798).
Galvani je leta 1780 odkril, da če se jim pridružijo en končni kabli različnih kovin in prosti konci, so bili v stiku z ANCA žabe (mrtve).
Vendar je bil prvi, ki je zgradil elektrokemijsko celico za proizvodnjo električne energije, tudi italijanski Alessandro Volta (1745-1827) leta 1800 in s tem tudi alternativno ime voltaične celice.
Deli galvanske celice
Deli galvanske celice so prikazani na sliki 1 in so naslednje:
1.- Anodna pol -media
2.- Anodijeva elektroda
3.- Anodna rešitev
4.- Katodna pol -media
5.- Katodna elektroda
6.- Katodna raztopina
7.- Slani most
8.- Kovinski dirigent
9.- Voltmeter
Delovanje
Da bi razložili delovanje galvanske celice, se bomo zanašali na spodnjo:
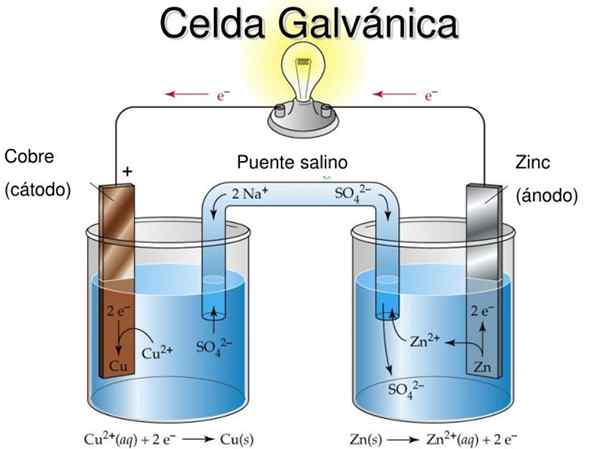 Slika 2. Didaktični model galvanske celice. Vir: SlideServe.com
Slika 2. Didaktični model galvanske celice. Vir: SlideServe.com Temeljna ideja galvanske celice je, da je kovina, ki jo trpi oksidacijska reakcija , Na primer, da prižgete žarnico ali LED.
Na sliki 2 na pol -mediji na levi strani imate kovinski bakreni trak (CU), potopljen v raztopino bakrenega sulfata (CUS04), Medtem ko je v desnem polčasu na voljo cinkov trak (Zn), potopljen v raztopino cinkovega sulfata (Znso4).
Treba je opozoriti, da je v vsakem pol -mediji kovina vsakega prisotna v dveh stanjih oksidacije: nevtralni kovinski atomi in kovinski ioni soli iste kovine v raztopini.
Če kovinskih trakov ni povezan z zunanjim prevodnim kablom, obe kovini oksidirata ločeno v svojih celicah.
Ko pa je električno povezan, se bo v Zn pojavila oksidacija, medtem ko bo v Cu prišlo do redukcijske reakcije. To je zato, ker je stopnja oksidacije cinka večja od stopnje bakra.
Kovina, ki oksidira, donosa kovine, ki se zmanjša skozi zunanji prevodnik, in ta trenutni tok je mogoče uporabiti.
Vam lahko služi: halogenirani derivatiReakcije oksidacije in redukcije
Reakcija, ki se pojavi na desni strani med cinkovo kovinsko elektrodo in vodno raztopino cinkovega sulfata, je naslednja:
Zntudi(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Atom cinka (trdne Kot pozitiven dvojni ion cinka.
Spoznali smo, da je neto rezultat, da je atom nevtralnega kovinskega cinka z izgubo dveh elektronov postal ion cinka, ki doda vodno raztopino, tako da je cinkasta palica izgubila atom in raztopina je pridobila pozitiven dvojni ion.
Osvobodeni elektroni se bodo raje premikali skozi zunanji kabel proti kovini drugega pol -media s pozitivno obremenitvijo (Cartodo +). Cinkova palica izgublja maso, saj njeni atomi postopoma prehajajo v vodno raztopino.
Oksidacija cinka je mogoče povzeti na naslednji način:
Zntudi(S) → Zn2+(AC) + 2 e-
Reakcija, ki se pojavi na levi strani, je podobna, vendar baker vodne raztopine zajame dva elektrona (ki prihaja iz drugega polmade) in se odloži v bakreno elektrodo. Ko atom zajame elektrone, naj bi se zmanjšalo.
Reakcija zmanjšanja bakra je napisana tako:
Cu2+(AC) + 2 e- → Cutudi(S)
Bakrena vrstica pridobiva testo, saj ioni raztopine preidejo v baru.
Oksidacija se pojavi v anodi (negativni), ki odbija elektrone, medtem ko se zmanjšanje pojavi v katodi (pozitivno), ki privablja elektrone. Izmenjava elektronov se zgodi prek zunanjega gonilnika.
Slani most
Slani most uravnoteži obremenitve, ki se nabirajo v obeh polletnih. V anodnih pol -ti -deadi pozitivnih ionov se nabirajo, v katodnem pa je presežek negativnih sulfatnih ionov.
Za slani most se uporablja raztopina soli (kot sta natrijev klorid ali kalijev klorid), ki ne posreduje v reakciji, ki je v obrnjeni cevi, ki je v obliki črke, s konci, priključen na steno poroznega materiala.
Edini namen slane mostu je, da se ioni filtrirajo na vsako celico, ki uravnoteži ali nevtralizira presežno obremenitev. Tako je skozi slani most trenutni pretok, skozi fiziološke ione, ki zapre električno vezje.
Potenciali oksidacije in redukcije
Standardni potenciali oksidacije in redukcije se razumejo.
Lahko vam služi: Scandio: Zgodovina, lastnosti, reakcije, tveganja in uporabeZa cink je njegov standardni oksidacijski potencialvol = +0,76 v. Medtem je standardni potencial zmanjšanja za baker inmreža = +0,34 v. Elektromotivna sila (FEM), ki jo proizvaja ta galvanska celica, je: FEM = +0,76 V + 0,34 V = 1,1 V.
Globalno reakcijo galvanske celice je mogoče zapisati tako:
Zntudi(S) + Cu2+(AC) → Zn2+(AC) + Cutudi(S)
Upoštevanje sulfata je neto reakcija::
Zntudi(S) + Cu2+ (SW4)2- 25 ° C → Zn2+ (SW4)2-+ Cutudi(S)
Sulfat je gledalec, medtem ko kovine izmenjajo elektrone.
Simbolni prikaz galvanske celice
Galvanska celica slike 2 je simbolično predstavljena na naslednji način:
Zntudi(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | cutudi(S)
Z konvencijo na levi kovini, ki oksidira in tvori anodo (-) in ločena z palico (|), je njen ion v vodnem stanju vedno nameščen. Anodni pol -medium je ločen od katodnega z dvema palicama (||), ki predstavlja slani most. Na desni se kovinski pol -medium zmanjša in tvori katodo (+).
V simbolični predstavitvi galvanske celice je konec vedno kovina, ki oksidira, na koncu pa je kovina (v trdnem stanju), ki se zmanjša. Treba je opozoriti, da so na sliki 2 polke v zvezi s konvencionalno simbolično reprezentacijo.
Prijave
Znano standardne oksidacijske potenciale različnih kovin. Možno je določiti elektromotivno silo, ki bo ustvarila galvanski kup, zgrajen s temi kovinami.
V tem razdelku se bo zgoraj navedeno uporabljalo v prejšnjih razdelkih za izračun neto elektromotorne sile celice, zgrajene z drugimi kovinami.
Kot primer uporabe upoštevamo galvansko železno celico (vera) in baker (CU). Kot podatki so podani naslednje reakcije redukcije in njegov standardni potencial redukcije, torej pri koncentraciji 25 ° C in 1M:
Vera2+(AC) + 2 e- → Vera(S). E1mreža = -0,44 v
Cu2+(AC) + 2 e- → Cu(S). E2mreža = +0,34 v
Zahteva se, da najdejo neto elektromotorno silo, ki jo proizvaja naslednja galvanska celica:
Vera(S)| Vera2+(AC)(1m) || cu2+(AC)| Cu(S)
V tem kupu je železo oksidira in je anoda galvanske celice, medtem ko se baker zmanjšuje in je katoda. Potencial oksidacije železa je enak, vendar v nasprotju z njegovim potencialom redukcije, to je E1Oxd = +0.44.
Za pridobitev elektromotivne sile, ki jo proizvaja ta galvanska celica, dodamo potencial oksidacije železa s potencialom zmanjšanja bakra:
Vam lahko služi: dušikovi oksidi (NOX)fem = e1Oxd + E2mreža = -E1mreža + E2mreža = 0,44 V + 0,34 V = 0,78 V.
Galvanska celica v vsakdanjem življenju
Galvanske celice za vsakodnevno uporabo so daleč od oblike, ki se uporablja kot didaktični model, vendar je njihovo načelo delovanja enako.
Najpogostejša celica uporabe je 1,5 V alkalna baterija v različnih predstavitvah. Prvo ime prihaja, ker je niz celic, povezanih serijsko, da bi povečali FEM.
Ponovne litijeve baterije temeljijo tudi na istem načelu delovanja galvanskih celic in so tiste, ki se uporabljajo v pametnih telefonih, urah in drugih napravah.
Na enak način so svinčene baterije avtomobilov, motociklov in čolnov 12 V in temeljijo na istem načelu delovanja galvanske celice.
Galvanske celice se uporabljajo pri estetiki in regeneraciji mišic. Obstajajo obrazne obdelave, ki so sestavljene iz uporabe toka z dvema elektrodama v obliki valja ali krogle, ki čistijo in tonificirajo kožo.
Trenutni impulzi veljajo tudi za regeneracijo muskulature pri ljudeh, ki so v stanju prostracije.
Gradnja domače galvanske celice
Obstaja veliko načinov za izgradnjo domače galvanske celice. Eden najpreprostejših je uporaba kisa kot raztopine, jeklenih nohtov in bakrenih kablov.
Materiali
-Plastične posode za enkratno uporabo
-Beli kis
-Dva jeklena vijaka
-Dva kosa gole bakrene žice (brez izolacije ali laka)
-Voltmeter
Postopek
-Napolnite ¾ dele kozarca s kisom.
-Pridružite se obema jeklenimi vijaki z več zavoji žice, pri čemer pustite kos žice brez navitja.
Neskončni konec bakrenega kabla je zložen v obrnjenem U -Shaped.
 Slika 3. Domača galvanska celica in multimeter. Vir: YouTube.com
Slika 3. Domača galvanska celica in multimeter. Vir: YouTube.com Še en kos bakrenega kabla je zložen v obrnjen in visi na robu stekla v diametralno nasproti položaju do potopljenih vijakov, tako da je en del bakra znotraj kisa in drugi del bakrenega kabla na zunanji strani kozarec.
Prosti konci kabli Voltmetra so priključeni za merjenje elektromotivne sile, ki jo proizvaja ta preprosta celica. FEM te vrste celice je 0,5 V. Če se želite ujemati s FEM alkalne baterije, je treba zgraditi še dve celici in se v seriji pridružiti trem, tako da dobimo 1,5 V baterijo
Reference
- Borneo, r. Galvanske in elektrolitske celice. Pridobljeno iz: razredi Quimice.Blogspot.com
- Cedrón, j. Splošna kemija. Pucp. Okrevano od: Korint.Pucp.Edu.pe
- Farrera, l. Uvod v elektrokemijo. Oddelek za fizikalnokemijo UNAM. Okreval od: depa.Fquim.Ne.mx.
- Wikipedija. Elektrokemijska celica. Okrevano od: je.Wikipedija.com.
- Wikipedija. Galvanska celica. Okrevano od: je.Wikipedija.com.

