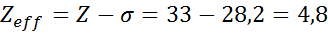Učinkovita jedrska obremenitev
- 1897
- 499
- Percy Feeney
Kaj je učinkovita jedrska obremenitev?
The Učinkovita jedrska obremenitev (predstavljeno kot zEff In v nekaterih primerih, kot je Z*) Neto jedrska obremenitev, ki jo doživlja elektron, ko je v polihelektronskem atomu (to je, ima več kot en elektron).
Na natančnejši način je električni naboj, ki bi imel jedro hipotetičnega atoma, ki lahko privabi svoj edini elektron z isto silo, s katerim jedro pravega atoma privabi ta isti elektron v prisotnosti vseh drugih elektronov.
To je popravljena jedrska obremenitev, ki upošteva učinek prisotnosti drugih elektronov na polilektronski atom. Ta zmanjšana obremenitev pojasnjuje, zakaj so najbolj oddaljeni elektroni v polielektronskem atomu šibkejšo povezani z jedrom kot notranji elektroni.
Učinkovita jedrska obremenitev je koncept velikega pomena v kemiji, saj nam omogoča, da razumemo periodično težnjo številnih lastnosti, kot so atomski polmer, polmer ionov, elektronegativnost, ionizacijske energije in še več.
Zakaj obstaja učinkovita jedrska obremenitev?
Učinkovita jedrska obremenitev izhaja iz dveh pojavov:
- Zaščitni učinek elektronov na polihelektronske atome.
- Elektrostatična odboj med elektroni, ker ima vsak enak električni naboj.
On učinek zaščite Sestavljen je iz neke vrste ščita, ki ga tvorijo notranji elektroni atoma, ki pokriva jedro. Zaradi tega se zdi, da so zunanji elektroni "manjši atrakciji jedra, kot bi se počutili, če drugi elektroni ne bi bili prisotni.
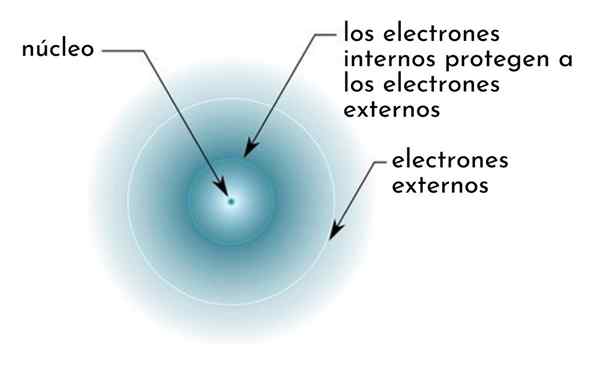 Slika shematično prikazuje notranje elektrone, ki delujejo kot zaslon, ki ščiti zunanje elektrone privlačnosti jedra
Slika shematično prikazuje notranje elektrone, ki delujejo kot zaslon, ki ščiti zunanje elektrone privlačnosti jedra Na primer, jedrska obremenitev natrijevega atoma je +11 (njeno atomsko število je z = 11), vendar, edini elektron Valencije, ki ga ima, dejansko čuti silo privlačnosti le obremenitve samo +2,2.
Vam lahko služi: natrijev benzoat: struktura, lastnosti, uporabe in tveganjaZ drugimi besedami, zaščita ostalih 10 notranjih elektronov povzroči, da Valencia elektron natrija čuti silo jedrske privlačnosti samo petine tistega, kar bi moralo biti.
Poleg zaščitnega učinka odboj med elektroni (ki imajo enak električni naboj) prav tako prispeva k preprečevanju zmogljivosti jedra za privabljanje zunanjih elektronov. To pomeni, da ta odbojka pomaga tudi zmanjšati učinkovito jedrsko obremenitev.
Pomembne značilnosti učinkovite jedrske obremenitve
Upoštevati je treba, da zaščitni učinek, odgovoren za zmanjšanje učinkovite jedrske obremenitve, vpliva le. Poleg tega učinek ni enak za elektrone, ki jih najdemo v atomskih orbitalih S in P kot tisti, ki jih najdemo v orbitalih D in F.
Zaradi tega se vsak nabor elektronov vsake plasti ali energijske ravni počuti drugačno učinkovito jedrsko obremenitev. To ima pomembne posledice glede kemijskih lastnosti različnih elementov.
Periodični trend učinkovite jedrske obremenitve
V obdobju
Elektroni, ki se nahajajo na isti ravni energije, so manj zaščitni kot tisti v nižji ravni energije.
Zaradi tega se učinek zaščite ne poveča bistveno, ko se premikamo v obdobju, vendar resnična jedrska obremenitev. Zaradi tega je učinkovita jedrska obremenitev povečanje od leve proti desni v periodični tabeli.
V celotni skupini
Po drugi strani pa se ob prehodu iz enega obdobja v drugo v isti skupini (torej, ko se premikamo po skupini), dodajo celotne plasti zelo zaščitnih notranjih elektronov. Zaradi tega se učinkovita jedrska obremenitev zmanjšuje od zgoraj navzdol ali, kaj je isto, povečanje od spodaj navzgor.
Vam lahko služi: ayaroínaUčinkovita formula jedrske obremenitve
Učinkovito jedrsko obremenitev je mogoče izračunati z zelo preprostim polčasnim enačbo, ki upošteva dejansko vrednost jedrske obremenitve (ki jo daje atomsko število, z) in izraz, imenovan konstantno zaščito. Slednje obsega učinke prisotnosti drugih elektronov v enem.
Enačba je podana z:
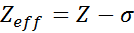
kjer je z atomsko število in σ (grška črka sigma) predstavlja zaščitno konstanto, ki je odvisna od elektronske konfiguracije.
Pravila Slater
Zaščitna konstanta je mogoče oceniti iz sistema, znanega kot pravila Slater. Ta pravila omogočajo izračun konstante ščita elektrona z dodajanjem prispevkov drugih elektronov v omenjeno zaščitno konstanto. Ta pravila je mogoče povzeti na naslednji način:
- Kateri koli elektron, ki je na isti ravni energije (raven n0) Zagotavlja količino 0,35 do konstante zaščite, razen če sta oba na ravni 1, v tem primeru pa 0,30.
- Vsak elektron, ki je na takojšnji prejšnji ravni (na ravni N0-1) V orbitalnem S ali P prinaša 0,85; Po drugi strani pa, če je v orbitalu d ali f, prispeva 1.
- Vsi drugi elektroni, ki so na nižji ravni energije (n0-2, n0-3 itd.), prispevajte 1 k konstanti zaščite.
Primer učinkovitega izračuna jedrske obremenitve
Valencia elektron natrijevega atoma
Elektronska konfiguracija natrijevega atoma je 1S22s22 p63s1. To pomeni, da če želimo izračunati učinkovito jedrsko obremenitev, ki jo čuti Valencia Electron (elektron 3s1), moramo dodati prispevke ostalih 10 elektronov po pravilih Slaterja.
Vam lahko služi: železov oksid (ii): struktura, nomenklatura, lastnosti, uporabeKako izračunamo konstanto 3S elektronskega ščita1 (n0= 3) In to je samo v plasti Valencije, na isti ravni energije ni drugih elektronov.
Takojšnja prejšnja raven je n0-1 = 2, kjer je v orbitali S ali P 8 elektronov, ki prispevajo 0,85, v orbitalih D ali F pa ni elektronov.
Končno je edina raven nižja od 2, n = 1, v kateri sta samo 2 elektrona. Vse to je povzeto v naslednji tabeli:
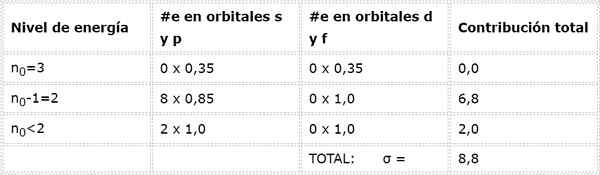
Kot je razvidno, notranji elektroni natrija zagotavljajo konstanto ščita 8,8, tako da učinkovita jedrska obremenitev, ki jo elektron čuti1 je:
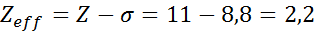
Arzen Valencia Elektroni
Elektronska konfiguracija arzena je 1S22s22 p63s23P63D104s24p3. Plast Valencia je plast 4 (n0= 4) To ima 5 elektronov: (4s24p3). V tem primeru bo vsak od teh 5 elektronov začutil učinek ostalih 4, ki so v isti plasti, in drugih 28 notranjih elektronov, kot je prikazano v tabeli:
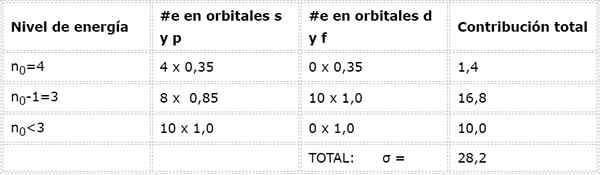
Zato je učinkovita jedrska obremenitev, ki jo čutijo arzeninski valencia elektroni: