Ogljik

- 2634
- 768
- Don Nitzsche
Kaj je ogljik?
On ogljik Gre za nemetalni kemični element, katerega kemični simbol je c. Ime je posledica premoga, zelenjave ali minerala, kjer njeni atomi definirajo različne strukture. Tvori široko paleto organskih in anorganskih spojin, prav tako pa se predstavlja v velikem številu alotropov.
Ogljik najdemo pri vseh živih bitjih; Vse njegove biomolekule dolgujejo svoj obstoj stabilnosti in moči vezi C-C ter njihovi visoki nagnjenosti k združevanju. To je element življenja in z njihovimi atomi so zgrajena njihova telesa.
Organske spojine, s katerimi se gradijo biomateriali. Te je mogoče videti na prvi pogled v lesu dreves; In tudi, ko strele pade nanje in Rostiza. Preostala inertna črna trdna trdnost ima tudi ogljik; Je pa zelenjavni premog.
Ogljikove lastnosti
Fizikalne ali kemijske lastnosti, ki jih najdemo v trdnih snovi, mineralih ali ogljikovih materialih, so podvržene številnim spremenljivkam. Med njimi so: sestava ali stopnja nečistoč, hibridacije ogljikovih atomov, raznolikost struktur ter morfologija ali velikost pore.
Ko opisujejo lastnosti ogljika, večina bibliografskih besedil ali virov temelji na grafitu in diamantu.
Ker? Ker so najbolj znani alotropi za ta element in predstavljajo trdne snovi ali materiale z visoko čistostjo; to pomeni, da praktično ne naredijo nič drugega kot ogljikove atome (čeprav z različnimi strukturami, kot bo razloženo v naslednjem razdelku).
Lastnosti zelenjavnega in mineralnega premoga se razlikujejo po izvoru ali sestavkih. Na primer, lignit (slab ogljik) kot gorivo Gatea v primerjavi z antracitom (bogato z ogljikom). In kaj povedati o drugih alotropih: nanocevke, fulerenos, grafen, grafos itd.
Vendar imajo kemično skupno točko: oksidirajo s presežkom kisika v CO2:
C + Tudi2 => Co2
Zdaj sta hitrost ali temperatura, ki jo potrebujejo za oksidacijo, lastna za vsakega od teh alotropov.
Graphite vs diamant
Tu bo podan tudi kratek komentar glede različnih lastnosti teh dveh alotropov:
 Tabela, v kateri primerjamo nekatere lastnosti obeh kristalnih alotrop ogljika. Vir: Gabriel Bolívar.
Tabela, v kateri primerjamo nekatere lastnosti obeh kristalnih alotrop ogljika. Vir: Gabriel Bolívar. Elektronska struktura in konfiguracija
Hibridacije
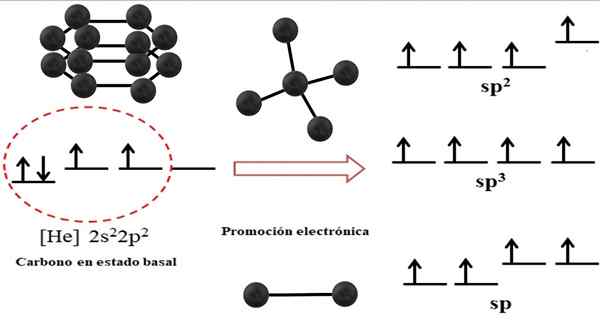 Razmerje med hibridnimi orbitali in možnimi strukturami za ogljik. Vir: Gabriel Bolívar.
Razmerje med hibridnimi orbitali in možnimi strukturami za ogljik. Vir: Gabriel Bolívar. Elektronska konfiguracija ogljikovega atoma je 1S22s22 p2, tudi napisan kot [on] 2s22 p2 (Zgornja slika). Ta predstavitev ustreza njegovemu bazalnemu statusu: atom ogljika, izoliran in suspendiran v takšnem vakuumu, ki ne more interakcijo z drugimi.
Vam lahko služi: kristalna strukturaCenimo, da ena od njegovih 2P orbital nima elektronov, ki z elektronsko promocijo sprejema elektron manjše energijske orbitale; In tako atom pridobi sposobnost tvorjenja do štiri kovalentne vezi s svojimi štirimi hibridnimi orbitali SP3.
Upoštevajte, da so štiri orbitale sp3 So degenerirani v energiji (poravnani na isti ravni). Orbitale str Čisti so bolj energični, zato so nad drugimi hibridnimi orbitali (desno od slike).
Če obstajajo tri hibridne orbitale, je to zato, ker orbital ostane str brez hibridizacije; Zato so tri orbitale SP2. In ko obstajata dve od teh hibridnih orbitalov, dve orbitali str Na voljo so za tvorbo dvojnih ali trojnih vezi, ki so hibridizacija F ogljika.
Takšni elektronski vidiki so bistveni za razumevanje, zakaj je ogljik mogoče najti v alotropnih neskončnosti.
Oksidacijske številke
Preden nadaljujete s strukturami, drugi niso omenjeni, da glede na elektronsko konfiguracijo Valencije 2s22 p2, Ogljik ima lahko naslednje oksidacijske številke: +4, +2, 0, -2 in -4.
Ker? Te številke ustrezajo predpostavki, da obstaja ionska vez, tako da oblikujete ione z ustreznimi obremenitvami; to je, c4+, C2+, C0 (nevtralno), c2- in c4-.
Da ima ogljik pozitivno oksidacijsko številko, mora izgubiti elektrone; In to storiti, je nujno, da je povezan z zelo elektronegativnimi atomi (na primer kisik).
Medtem, da ima ogljik negativno oksidacijsko številko, mora pridobiti elektrone, ki se povezujejo s kovinskimi ali manj elektronegativnimi atomi kot on (na primer vodik).
Prvo vprašanje oksidacije +4 pomeni, da je ogljik izgubil vse valenčne elektrone; Orbitala 2s in 2p sta prazna. Če 2P orbital izgubi dva elektrona, bo ogljik imel +2 oksidacijske številke; Če osvojite dva elektrona, boste imeli -2; In če osvoji dva elektrona, ki je več dokončala svoj oktet iz Valencije, -4.
Primeri
Na primer za co2 Številka oksidacije ogljika je +4 (ker je kisik bolj elektronegativen); medtem ko za Cho4, je -4 (ker je vodik manj elektronegativen).
Vam lahko služi: hidrazin: struktura, lastnosti, sinteza, uporabaZa pogl3Oh, številka oksidacije ogljika je -2 (+1 za H in -2 za O); Medtem ko je za HCOOH, je +2 (preverite, ali je vsota 0).
Verjetno so tudi druga oksidacijska stanja, kot sta -3 in +3, še posebej, če gre za organske molekule; Na primer v metilnih skupinah -CH3.
Molekularne geometrije
Na vrhunski sliki ni bila prikazana samo hibridizacija orbitalov za ogljikov atom, ampak tudi nastale molekularne geometrije, ko je več atomov (črnih kroglic) povezano z osrednjo. Ta osrednji atom za odstranjevanje specifičnega geometrijskega okolja v vesolju mora imeti ustrezno kemično hibridizacijo, ki je dovoljena.
Na primer, za tetraeder ima osrednji ogljik hibridizacijo SP3; Ker je taka najbolj stabilna ureditev za štiri hibridne sp3. V primeru SP ogljikov2, Lahko tvorijo dvojne povezave in odlagajo trigonalno ravno okolje; In tako, ti trikotniki opredeljujejo popoln šesterokotnik. In za hibridizacijo SP ogljikovodiki sprejemajo linearno geometrijo.
Tako se geometrije, opažene v strukturah vseh alotropov, preprosto urejajo v tetraedri (SP3), šesterokotniki ali pentagoni (sp2) in črte (sp).
Tetrahedra določa 3D strukturo, medtem ko šesterokotnik, pentagoni in črte, 3D ali 2D strukture; Slednje so letala ali listi, podobni stenam čebeljih satja:
 Stena s šesterokotnimi dizajni čebeljega satja po analogiji z ravninami, sestavljenimi iz ogljika SP2. Vir: Pixabay.
Stena s šesterokotnimi dizajni čebeljega satja po analogiji z ravninami, sestavljenimi iz ogljika SP2. Vir: Pixabay. In če zložimo to šesterokotno steno (petegonalno ali mešano), bomo dobili cev (nanocevke) ali kroglico (fulerena) ali drugo številko. Interakcije med temi številkami povzročajo različne morfologije.
Amorfne ali kristalne trdne snovi
Če pustijo geometrije, hibridizacije ali morfologije možnih ogljikovih struktur, se njihove trdne snovi lahko uvrstijo po globalnosti v dve vrsti: amorfno ali kristalno. In med tema dvema klasifikacijama se porazdelijo njihovi alotropi.
Amorfni ogljik je preprosto tisti, ki predstavlja poljubno mešanico tetraedre, šesterokotnikov ali linij, ki ne more vzpostaviti strukturnega vzorca; Takšen je primer premoga, zelenjave ali aktiviranega premoga, koksa, saje itd.
Medtem ko je kristalni ogljik sestavljen iz strukturnih vzorcev, ki jih tvori kateri koli od dvignjenih geometrij; Na primer, diamant (tridimenzionalna mreža tetraedre) in grafit (zloženi šesterokotni listi).
Vam lahko služi: natrijev nitrat (nano3): struktura, lastnosti, uporabe, tveganjaKje je ogljik?
Poleg tega, da je kemični element, ki je pogost v vseh oblikah življenja, je ogljik v naravi prisoten v treh kristalnih oblikah: diamant, grafit in vodnik.
Obstaja tudi več amorfnih mineralnih oblik premoga (antracit, lignit, neumna, šota), tekoče oblike (sorte nafte) in soda (zemeljski plin).
Prijave
Ponovno so, tako kot lastnosti in struktura, uporabe ali aplikacije skladne z alotrogomi ali mineraloškimi oblikami ogljika. Vendar pa obstajajo določene splošnosti, ki jih je mogoče omeniti, poleg nekaterih zelo znanih točk. Takšni so:
-Carbon se že dolgo uporablja kot sredstvo za zmanjšanje mineralov pri pridobivanju čistih kovin; Na primer železo, silicij in fosfor, med drugim.
-To je temelj življenja, organska kemija in biokemija pa so študije tega razmišljanja.
-To je tudi fosilno gorivo, ki je omogočilo, da so prvi stroji odšli v svoje prestave. Na enak način je bil od njega pridobljen ogljikov plin za stare svetlobne sisteme. Premog je bil sinonim za svetlobo, toploto in energijo.
-Mešano kot dodatek z železom v različnih razmerjih je omogočilo izum in izboljšanje jekel.
-Njegova črna barva je potekala v umetnosti, še posebej grafitu in vseh spisih, narejenih z njihovimi potezami.
Tveganja in previdnostni ukrepi
Ogljik in njene trdne snovi ne predstavljajo tveganja za zdravje. Ki je skrbel za vrečko za premog? Prodajajo jih sklopi v dvoranah nekaterih trgov, in dokler ni blizu požara, njihovi črni bloki ne bodo goreli.
Koks na drugi strani lahko predstavlja tveganje, če je vsebnost žvepla visoka. Ko zgorevanje sprosti žveplove pline, ki poleg strupenih prispevajo k kislemu dežju. In čeprav co2 V majhnih količinah nas ne more zadušiti, kar močno vpliva na okolje kot toplogredni plin.
S tega vidika je ogljik "dolgoročna" nevarnost, saj njegovo zgorevanje spreminja podnebje našega planeta.
In v bolj fizičnem smislu trdne snovi ali ogljikove materiale, če jih razpršijo, zlahka prevažajo z zračnimi tokovi; In posledično jih uvedejo neposredno v pljuča, kar jih lahko nepošteno poškoduje.
Preostalega je zelo pogosto porabiti "premog", ko nekaj hrane kuha.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.

