Struktura kalijevega karbonata (K2CO3), lastnosti, uporabe, pridobivanje

- 3571
- 1066
- Ms. Pablo Lebsack
On Kalijev karbonat Gre za anorgansko spojino, ki jo tvorita dva kalijeva iona k+ in premogovni ion co32-. Njegova kemična formula je k2Co3. Gre za higroskopsko belo trdno snov, to je, da zlahka absorbira vodo iz okolja. Zato se v laboratorijih uporablja za absorpcijo vode iz drugih snovi.
Zelo topno je v alkalnih raztopinah, ki tvorijo vodo, ki so bogate z OH ioni-in torej z visoko pH vrednostjo. Njegove vodne raztopine, ker so alkalne, se uporabljajo v več industrijskih procesih za absorpcijo kislinskih plinov, kot je ogljikov dioksid2 in vodikov sulfid h2S, nato jih zlahka nevtralizira.
 Kalijev karbonat K2Co3 trden. Ondřej mangl [javna domena]. Vir: Wikimedia Commons.
Kalijev karbonat K2Co3 trden. Ondřej mangl [javna domena]. Vir: Wikimedia Commons. K2Co3 Uporablja se za pripravo mil, čiščenja izdelkov, detergentov za pranje oblačil in mešanic za pranje posode. Uporablja se tudi pri obdelavi nekaterih tekstilnih vlaken, kot je volna.
Široko se uporablja v kemijskih laboratorijih, na primer za absorpcijo vode iz drugih spojin ali za alkalizacijo mešanic kemijskih reakcij in tudi v kemični analizi.
Dodana se tudi nekaterim živilom, na primer za odpravo grenkega okusa semen kakava med proizvodnjo čokolade.
[TOC]
Struktura
Kalijev karbonat sestavljata dva kationa kalije+ in karbonat anion co32-. Karbonatni anion ima ravno in simetrično strukturo, trije atomi kisika.
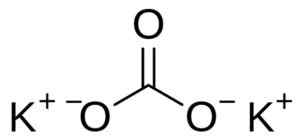 Struktura kalijevega karbonata k2Co3. Uporabnik: edgar181 [javna domena]. Vir: Wikimedia Commons.
Struktura kalijevega karbonata k2Co3. Uporabnik: edgar181 [javna domena]. Vir: Wikimedia Commons. Nomenklatura
- Kalijev karbonat
- Kalijev karbonat
- Dipotasijev karbonat
- Kalic
- Kalijeva sol karbonske kisline.
Lastnosti
Fizično stanje
Kristalno trdno brezbarvno do bele.
Molekularna teža
138,205 g/mol.
Tališče
899 ° C.
Vrelišče
Razpade.
Gostota
2,29 g/cm3
Topnost
Zelo topno v vodi: 111 g/100 g vode pri 25 ° C. Netopna v etanolu in acetonu.
Vam lahko služi: prispevki od kemije do medicineph
Vodna raztopina ima lahko pH 11,6, torej je precej alkalna.
Kemične lastnosti
Kalijev karbonat je delikue ali higroskopski, to je, da absorbira vlažnost okolja. Ima stabilen hidrat, k2Co3.2H2Tudi.
K2Co3 V vodni raztopini je hidroliziran, to je, da reagira z vodo tako, da sprosti OH skupine- ki so tisti, ki dajejo alkalnost rešitvam:
Co32- + H2Ali ⇔ oh- + HCO3-
HCO3- + H2Ali ⇔ oh- + H2Co3
Pridobivanje
Lahko dobimo iz preostalega pepela pri kurjenju rastlin. Tudi z karbonacijo koh kalijevega hidroksida, to je dodajanje odvečnega ogljikovega dioksida CO2 KOH:
Koh + co2 → khco3
2 khco3 + toplota → k2Co3 + H2Tudi
Drug način, kako ga pridobiti, je ogrevanje kalijevega klorida KCl z magnezijevim karbonatom3, voda in co2 pod pritiskom. Najprej dobimo dvojno hidrirano magnezij in kalijev sol in kalij3.Khco3.4H2Ali pa se imenuje Engels Salt:
2 kCl + 3 mgco3 + Co2 + 5 h2O → mgco3.Khco3.4H2Ali ↓ + mgcl2
Dvojno hidrirano sol Engels obori in loči od raztopine s filtracijo. Nato se karbonat kalijevega avtomobila segreje in oblikuje2Co3 da se z dodajanjem vode raztopi, medtem ko mgco magnezijev karbonat3 ostaja netopna in odpravljena s filtracijo.
MGCO3.Khco3.4H2O + toplota → mgco3↓ + 2 k+ + Co32- + Co2↑ + 9 h2Tudi
Prijave
V absorpciji co2 V industrijskih procesih
Raztopina kalijevega karbonata je klasična obdelava za odstranjevanje ogljikovega dioksida2 V različnih procesih, zlasti v aplikacijah z visokimi tlaki in temperaturami.
 K rešitve2Co3 Uporabljajo se za absorpcijo co2 V različnih industrijskih procesih. Avtor: Nicola Giordano. Vir: Pixabay.
K rešitve2Co3 Uporabljajo se za absorpcijo co2 V različnih industrijskih procesih. Avtor: Nicola Giordano. Vir: Pixabay. Odstranjevanje co2 se pojavi v skladu z naslednjo reakcijo:
K2Co3 + Co2 + H2Ali ⇔ 2 khco3
Ta metoda se uporablja na primer za zdravljenje zemeljskega plina. Tudi v rastlinah energije, da bi se izognili emisiji CO2 do ozračja in pri proizvodnji suhega ledu.
Vam lahko služi: bakreni hidroksid (ii): struktura, lastnosti, nomenklatura, uporabe K rešitve2Co3 Uporabljajo se za pridobivanje co2 ki služi za izdelavo suhega ledu. Projectmanhattan [CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
K rešitve2Co3 Uporabljajo se za pridobivanje co2 ki služi za izdelavo suhega ledu. Projectmanhattan [CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. K -solucija2Co3 Lahko je toplotno regenerirano, torej zaradi temperatur segrevanje približno 100 ° C.
Da bi raztopina kalijevega karbonata z dobro hitrostjo absorbirala CO2, se dodajo promotorji, ki pospešijo postopek, kot je dietanolamin (DEA).
Pri odstranitvi h2S določenih procesov
Raztopine kalijevega karbonata se uporabljajo tudi za odstranjevanje plina vodikovega sulfida H2S procesne tokove. Včasih dodamo kalijev tiffosfat k3Po4 za hitrejši postopek.
V kemijski laboratoriji
K2Co3 Omogoča organsko sintezo, na primer v kondenzacijskih reakcijah in nevtralizira. Služi za odstranjevanje vode iz organskih tekočin, kot dehidriranje ali sušilno sredstvo v laboratoriju.
Uporablja se tudi v analitični kemijski reakciji in za alkalizacijo v farmacevtski industriji.
V industriji čistilnih izdelkov
K2Co3 Uporablja se za izdelavo mila, čiščenja formul, izdelkov za oblačila in pranje jedi ter tudi za pripravo šampona in drugih izdelkov za osebno nego.
 K2Co3 Uporablja se pri pripravi mila. Lacrosus [javna domena]. Vir: Wikimedia Commons.
K2Co3 Uporablja se pri pripravi mila. Lacrosus [javna domena]. Vir: Wikimedia Commons. V živilski industriji
Kalijev karbonat dodamo različnim živilom z več namenami.
Na primer, semena kakava dodajo, da odpravijo njihov grenki okus in jih uporabijo v proizvodnji čokolade. V grozdju se doda v procesu sušenja, da dobimo rozidno grozdje.
 Kakavova semena se zdravi s k2Co3 Da bi zmanjšali svoj grenki okus pri izdelavi čokolade. Avtor: Magali Couret. Vir: Pixabay.
Kakavova semena se zdravi s k2Co3 Da bi zmanjšali svoj grenki okus pri izdelavi čokolade. Avtor: Magali Couret. Vir: Pixabay. V trgovini s pecivo se uporablja kot leudant (ki deluje kot kvas) moke za pripravo pečene hrane.
Vam lahko služi: lutecio: struktura, lastnosti, uporabe, pridobivanje K2Co3 Uporablja se lahko kot ledit v tortah, ker ko odda CO2 Med kuhanjem teh povečanja prostornine. Avtor: Pixel1. Vir: Pixabay.com
K2Co3 Uporablja se lahko kot ledit v tortah, ker ko odda CO2 Med kuhanjem teh povečanja prostornine. Avtor: Pixel1. Vir: Pixabay.com V gnojilih
K2Co3 Uporablja se za gnojenje kislinskih tal, kot premogovni ion co32- V stiku z vodo proizvajajo OH ioni- ki povečujejo pH tal. Poleg kalija k+ Je hranilo za rastline.
Kalijev karbonat se uporablja tudi za izdelavo gnojil s počasno sproščanjem.
Počasna sproščanje gnojila sprošča ali ohlapno hranila, tako da se ne raztopijo in vlečejo z vodo. Zahvaljujoč temu lahko porabijo več časa za rastlinske korenine.
V več aplikacijah
Kalijev karbonat K2Co3 Uporablja se tudi za:
- Postopki sušenja, beljenja in čistega čiščenja volne in drugih dejavnosti tekstilne industrije
- Pridobivanje drugih organskih in anorganskih kalijevih soli, kot je KCN kalijev cianid.
- Funkcija kot regulator kislosti v različnih procesih.
- Naredite keramiko in lončarstvo.
- Procesi graviranja in litografije.
- Porjavelost.
- Pripravite tiskana črnila, pigmenti.
- Manufacce steklo2Co3 Je bolj združljiv kot pri natrijevem karbonatu NA2Co3 S svincem, barijem in stroncijevimi oksidi, ki jih vsebujejo ta steklo.
- Čiščenje vode.
- Zakasnitev ogenj (v obliki vodnih raztopin).
- Zavirajo korozijo in kot sredstvo proti izenačevanju v procesnih skupinah.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Kalijev karbonat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Steele, d. (1966). Kemija kovinskih elementov. Pergamon Press Ltd. London.
- Mokhatab, s. et al. (2019). Zdravljenje zemeljskega plina. Raztopina kalijevega karbonata. V priročniku za prenos in predelavo zemeljskega plina (četrta izdaja). Okrevano od Scientirect.com.
- Kakaras, npr. et al. (2012). Sistemi kombiniranega cikla s fluidirano zgorevanje s fluidirano fluidno steno (PFBC). Izgorevanje s fluidno posteljo s pritiskom z zajemanjem in skladiščenjem ogljika. V kombiniranih ciklah za skoraj ničle emisijske energije. Okrevano od Scientirect.com.
- Speight, j.G. (2019). Proizvodnja vodika. Mokro čiščenje. Pri močnem predelavi in nadgradnji olja. Okrevano od Scientirect.com.
- Branan, c.R. (2005). Obdelava plina: Poglavje, ki ga je posodobil Chris Higman. Vročega karbonatnega procesa. V pravilih za kemijske inženirje (četrta izdaja). Okrevano od Scientirect.com.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. VCH Verlagsgellschaft MBH.
- Li, in. in Cheng, f. (2016). Sinteza novega kalijevega gnojila s počasnim sproščanjem iz modificirane žlindre pidgeon magnezija s kalijevim karbonatom. J Air Waste Manad Assoc, 2016 AUG; 66 (8): 758–67. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.

