Aluminijasta karbonatna struktura, lastnosti, uporabe
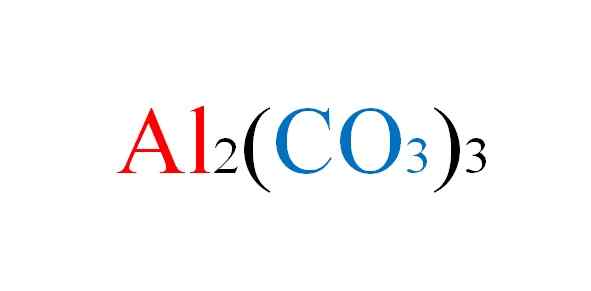
- 4695
- 736
- Percy Feeney
On Aluminijast karbonat Je anorganska sol, katere kemijska formula je2(Co3)3. Je praktično neenakomerni kovinski karbonat, glede na visoko nestabilnost v normalnih pogojih.
Med razlogi za njegovo nestabilnost lahko omenimo šibke elektrostatične interakcije med ioni3+ in co32-, ki bi moralo biti teoretično zelo močne za veličine njihovih obremenitev.
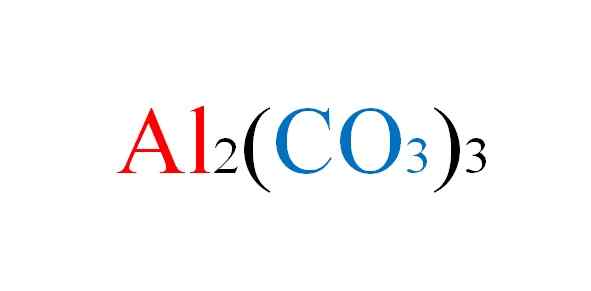 Aluminijasta karbonatna formula. Vir: Gabriel Bolívar.
Aluminijasta karbonatna formula. Vir: Gabriel Bolívar. Sol se sooča z morebitnimi neprijetnostmi v papirju, ko so napisane kemične enačbe njihovih reakcij; Toda v praksi je proti temu.
Kljub temu, kar je bilo rečeno, se lahko v družbi drugih ionov pojavi aluminijev karbonat, kot je to pri mineralu Dawsonite. Obstaja tudi derivat, v katerem deluje z vodnim amonijakom. Preostalega velja za mešanico med Al (OH)3 in h2Co3; ki je enaka šumeča raztopini z belo oborino.
Ta mešanica ima zdravilne namene. Vendar do čiste, izolirane in manipulirane soli al2(Co3)3, Ne poznate možnih aplikacij; Vsaj ne nizki veliki pritiski ali ekstremni pogoji.
[TOC]
Aluminijasta karbonatna struktura
Kristalna struktura za to sol ni znana, saj je tako nestabilna, da je ni bilo mogoče opisati. Od njegove formule do2(Co3)3, Vendar je znano, da je delež ionov z3+ in co32- Je 2: 3; to pomeni, da za vsaka dva kationa2+ Obstajajo trije anioni co32- elektrostatično interakcijo z njimi.
Težava je v tem, da sta oba iona zelo neenakomerna glede na njihove velikosti; al3+ Je zelo majhna, medtem ko je co32- Je zajetno. Ta razlika sama po sebi že vpliva na retikularno stabilnost kristalne mreže, katere ioni bi "nerodno" medsebojno vplivali, če bi bila ta sol v trdnem stanju izolirana.
Lahko vam služi: Avogadro Številka: Zgodovina, enote, kako se izračuna, uporabljaPoleg tega vidika al, al3+ To je zelo polarizirajoča kation, lastnost, ki deformira elektronski oblak CO32-. Kot da bi ga želel prisiliti, da se kovalentno poveže, čeprav anion tega ne more storiti.
Posledično ionske interakcije med al3+ in co32- Se nagibajo k kovalentnosti; Še en dejavnik, ki dodaja nestabilnost al2(Co3)3.
Hidroksid karbonat aluminijev amonij
Kaotični odnos med al3+ in co32- Po videzu se mehka, ko so v kozarcu prisotni drugi ioni; kot je NH4+ in oh-, iz raztopine amoniaka. Ta ionski kvartet3+, Co32-, Nh4+ in oh-, Uspejo določiti stabilne kristale, celo sposobni sprejeti različne morfologije.
Drug primer, podoben temu, opazimo v mineralu Dawsoninite in njegovih ortrorombičnih kristalih, Naalco3(OH)2, Kjer je na+ Zamenjajte NH4+. V teh soli so njihove ionske vezi dovolj močne, da voda ne spodbuja sproščanja CO2; ali vsaj ne naglo.
Čeprav NH4Al (OH)2Co3 (AACC, za svoje sigle v angleščini), niti Naalco3(OH)2 Predstavljajo aluminijev karbonat, jih lahko štejemo za osnovne derivate istega.
Lastnosti
Molarna masa
233,98 g/mol.
Nestabilnost
V prejšnjem razdelku je bil razložen z molekularne perspektive, zakaj Al2(Co3)3 Je nestabilno. Toda kakšna preobrazba trpi? Morate upoštevati dve situaciji: eno suho in drugo "mokro".
Suho
V suhih situaciji Anion Co32- CO je obrnjen2 skozi naslednjo razgradnjo:
Do2(Co3)3 => Al2Tudi3 + 3CO2
Lahko vam služi: kalcijev fosfat (CA3 (PO4) 2)Kar je smiselno, če je sintetizirano pod glinico do velikih pritiskov CO2; to je obratna reakcija:
Do2Tudi3 + 3CO2 => Al2(Co3)3
Zato, da se izognemo razpadu AL2(Co3)3 Sol bi morali oddati na velike pritiske (z uporabo n2, Na primer). Na ta način tvorba co2 ne bi bil termodinamično naklonjen.
Mokro
Medtem ko je v mokre situacije, co32- Trpi hidrolizo, ki ustvarja majhne količine OH-; Toda dovolj, da se aluminijev hidroksid obori, pri (OH)3:
Co32- + H2Ali HCO3- + Oh-
Do3+ + 3oh- Al (OH)3
In na drugi strani al, al3+ Je tudi hidroliziran:
Do3+ + H2Ali do (oh)22+ + H+
Čeprav bi bil res hidriran3+ Oblikovati kompleks do (h2Da)63+, ki je hidroliziran, da da [h2Da)5Oh]2+ in h3Tudi+. Potem, h3Ali (ali h+) Protona do co32- do h2Co3, ki se razgradi na co2 in h2Eno:
Co32- + 2H+ => H2Co3
H2Co3 Co2 + H2Tudi
Upoštevajte, da na koncu al3+ Se obnaša kot kislina (sprosti h+) in baza (sprostitev oh- Z ravnotežjem topnosti AL (OH)3); to pomeni, da ima amfoterizem.
Fizično
Da bi se lahko izolirali, je ta sol verjetno bela, kot številne druge aluminijaste soli. Tudi zaradi razlike med ionskimi radijskimi sprejemniki Al3+ in co32-, Zagotovo bi imel zelo nizke točke ali vrelišča v primerjavi z drugimi ionskimi spojinami.
Lahko vam služi: Benchilo: benzil vodiki, karbokacije, benzil radikaliIn glede njene topnosti bi bilo v vodi neskončno topno. Poleg tega bi bila higroskopska in okusna trdna. Vendar so to samo domneve. Druge lastnosti bi bilo treba oceniti z modeli računanja, ki so pod visokimi tlaki.
Prijave
Aplikacije, ki so znane iz aluminijevega karbonata. Uporabljali so ga kot mehko adstrigent in kot zdravilo za zdravljenje vnetja in želodčne razjede. Uporablja se tudi za preprečevanje nastanka urinskih izračunov pri ljudeh.
Uporablja se za nadzor povečanja vsebnosti telesa v fosfatu in tudi za zdravljenje simptomov želodčne kislosti, kisline in želodčne razjede.
Reference
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang l. (2012). Hidrotermalna sinteza amonijevega aluminijevega karbonatnega hidroksida (AACH) nanoplatet in nano vlakna PH-nadzorovanih morfologij. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Amonijev aluminijev karbonat hidroksid NH4AL (OH) 2CO3 kot alternativna pot za pripravo aluminija: Primerjava s klasičnim pregorkom Boehmit. Tehnologija v prahu, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Nacionalni center za informacije o biotehnologiji. (2019). Aluminijast karbonat. Baza podatkov Pubchem., Cid = 1035396. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Aluminijast karbonat. Pridobljeno iz: v.Wikipedija.org
- AluminumumUlfat. (2019). Aluminijast karbonat. Okrevano od: aluminumUlfat.mreža

