Plast Valencia
- 2534
- 253
- Stuart Armstrong
 Plast Valencije je tam, kjer se pojavljajo kemične reakcije
Plast Valencije je tam, kjer se pojavljajo kemične reakcije Kaj je plast Valencije?
The Plast Valencia To je, da čigar elektroni so odgovorni za kemijske lastnosti elementa. Elektroni v tej plasti sodelujejo s tistimi sosednjega atoma, da tvorijo kovalentne vezi (A-B); In če se izselijo iz enega atoma v drugega, bolj elektronegativne, ionske povezave (A+B-).
Ta plast je opredeljena z glavno kvantno številko n, kar posledično kaže na obdobje, ko je element nameščen v periodični tabeli. Medtem ko je naročanje po skupinah odvisno od števila elektronov, ki krožijo v plasti Valencije.
Tako da za a n Enako 2, lahko zasedete osem elektronov: osem skupin (1-8).
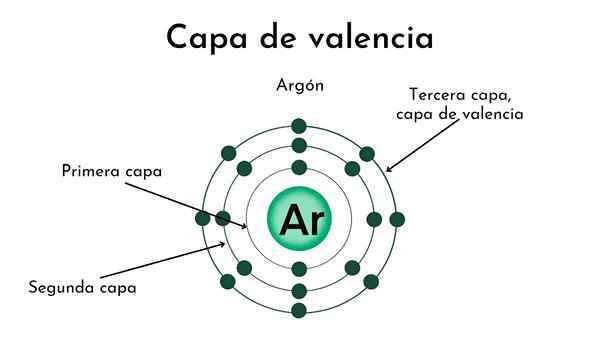
 Jedro atoma s štirimi plastmi. Vir: Gabriel Bolívar
Jedro atoma s štirimi plastmi. Vir: Gabriel Bolívar Na zgornji sliki in pokrovu je prikazan pomen plasti Valencije. Črna točka v središču atoma je jedro, preostali koncentrični krogi n.
Koliko plasti ima ta atom? Vsak od njih ima svojo barvo, in ko je štiri, ima atom štiri plasti (n= 4).
Upoštevajte, da se barva razpada, ko se razdalja od plasti poveča na jedro. Plast Valencije je tista, ki je bolj oddaljena od jedra: najjasnejša barva.
Kaj je plast Valencije?
Glede na sliko plast Valencije ni nič drugega kot zadnje orbitale atoma, ki jih zasedajo elektroni. V svetlo modri plasti, za n= 4 Obstaja serija 4S, 4P, 4D in 4F orbital; Se pravi, znotraj so tudi druge podkopanike z različnimi elektronskimi zmogljivostmi.
Atom potrebuje elektrone, da zapolni vse 4N orbitale. Ta postopek lahko opazimo v elektronskih konfiguracijah elementov v obdobju.
Vam lahko služi: linearne alkane: struktura, lastnosti, nomenklatura, primeriNa primer, kalij ima elektronsko konfiguracijo [AR] 4S1, Medtem ko kalcij na vaši desni, [ar] 4s2.
V skladu s temi konfiguracijami, kakšna je plast Valencije? Izraz [AR] se nanaša na elektronsko konfiguracijo plemenitega plina Argon 1S22s22 p63s23P6. To predstavlja notranjo ali zaprto plast (ki je znana tudi kot Jedro).
Ker je orbitala 4S tista z največjo energijo in v katerem vstopijo novi elektroni, predstavlja valenčno plast tako za K kot za CA. Če bi atoma K in CA primerjali z atomom slike, bi bile [AR] vse notranje plasti modre; in 4s svetlo modra plast, zunanja.
Značilnosti plasti Valencia
Iz zgoraj navedenega lahko nekatere značilnosti plasti Valencije povzamemo za vse atome:
-Njegova raven energije je višja; Kaj je enako, je bolj umaknjeno iz jedra in ima najnižjo elektronsko gostoto (v primerjavi z drugimi plastmi).
-To je nepopolno. Zato bo še naprej napolnjen z elektroni, saj obdobje od leve proti desni potuje po periodični tabeli.
-Posega v oblikovanje kovalentnih ali ionskih povezav.
V primeru kalijevih in kalcijevih kovin oksidirajo, da se preoblikujejo v katione. K+ Ima elektronsko konfiguracijo [AR], ker izgubi edino 4S zunanje elektron1. In na strani CA2+, Njegova konfiguracija je tudi [AR]; Ker namesto izgube elektrona izgubi dva (4s2).
Toda kakšna je razlika med k+ in ca2+, Če oba izgubita elektrona svoje valenčne plasti in imata elektronsko konfiguracijo [AR]? Razlika je v njegovih ionskih radijih.
Vam lahko služi: živosrebrni oksid (HG2O)AC2+ je manjši od k+ Ker ima atom kalcija dodaten proton, ki privabi zunanje elektrone (zaprta ali Valencia) več sile).
Plast Valencia 4S ni izginila: za te ione je prazen samo.
Primeri plasti Valencia
Koncept plasti Valencije je lahko neposredno ali posredno v mnogih vidikih kemije.
Ker so njihovi elektroni tisti, ki sodelujejo pri oblikovanju vezi, vsaka tema, ki jih obravnava (TEV, RPECV, reakcijski mehanizmi itd.) Morate se sklicevati na omenjeno plast.
To je zato, ker so, pomembnejši od valenčne plasti, njeni elektroni, imenovani Valencia Electrons. Ko predstavljajo progresivno konstrukcijo elektronskih konfiguracij, definirajo elektronsko strukturo atoma in s tem tudi njene kemijske lastnosti.
Iz teh informacij iz enega atoma A in drugega B je mogoče strukture njihovih spojin lahko postavljene skozi Lewisove strukture. Prav tako lahko elektronske in molekularne strukture različnih spojin določimo zahvaljujoč številu valenčnih elektronov.
Možni in najpreprostejši primeri valenčnih plasti so v periodični tabeli; Konkretno v elektronskih konfiguracijah.
Primer 1
V periodični tabeli je mogoče identificirati element in njegovo lokacijo samo z elektronsko konfiguracijo. Če ima element X konfiguracijo [KR] 5S25 str1, Za kaj gre in kakšno obdobje in skupina pripadajo?
Glede na n= 5, x je v petem obdobju. Poleg tega ima tri elektrone Valencije: dva v 5S orbitali2 In enega v 5p1. Notranji sloj [KR] ne daje več informacij.
Lahko vam služi: bromhidric kislina (HBR)Ker ima X tri elektrone, njegove 5p orbitale pa so nepopolne, je v bloku P; Poleg tega v skupini IIIA (Romanesque) ali 13 (trenutni sistem za oštevilčenje IUPAC). X je nato indijski element, v.
Primer 2
Kaj je element x z elektronsko konfiguracijo [KR] 4D105s1? Upoštevajte, da tako kot IN spada v obdobje 5, saj 5S orbital1 je največ energije. Vendar plast Valencia vključuje tudi 4D orbitale, saj so nepopolno.
Plasti Valencije lahko nato označimo kot NSNP za element bloka P ali S; ali (N-1) DNS, za element bloka D. Tako da skrivnostni element X pripada bloku D, ker je njegova elektronska konfiguracija tipa (N-1) DNS (4D105s1).
Katera skupina pripada? Dodajanje deset elektronov 4D orbitala10, in eden od 5s1, X ima enajst elektronov iz Valencije. Zato se mora nahajati v skupini Ib U 11. Nato potujete skozi 5. obdobje periodične tabele do skupine 11, dosežete srebrni element, AG.
Reference
- Shiver & Atkins. (2008). Anorganska kemija (četrta izdaja, str. 23). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. Kemija (8. izd.). Cengage Learning, P. 287.
- NDT Resource Center.F.). Valenčna lupina. Vzeto od: Nde-ed.org
- Clackamas Community College (2002). Valenčni elektroni. Pridobljeno iz: dl.Clackamas.Edu
- Kemija librettexts.F.). Valence in Core Electrons. Okrevano od: kem.Librettexts.org

