Toplota zgorevanja

- 4706
- 1012
- Roman Schamberger
Kakšna je toplota zgorevanja?
On Toplota zgorevanja To je energija, ki se sprosti, ko določena količina materiala, običajno en mol, eksotermično reagira s kisikom zraka. To je bistvena lastnost termokemije pri karakterizaciji goriv, alkoholov in zlasti ogljikovodikov, kot sta butan in metan.
Ko snov gori svetlobo in toploto, energijo, ki jo lahko uporabimo za delo na drugih telesih. Na primer, ustvarjena toplota je sposobna segreti velike količine vode, katere para pritiska na okolico in deluje nekaj električnih generatorjev; ali preprosto, nadaljnje segrevanje parjene hrane.
 Toplota, ki nastane z izgorevanjem kuhinjskega plina, se uporablja za ogrevanje kot
Toplota, ki nastane z izgorevanjem kuhinjskega plina, se uporablja za ogrevanje kot Toplota zgorevanja se razlikuje med vsemi snovmi, čeprav je njegova kemična narava v bistvu enaka. Ta sprememba ustreza relativni stabilnosti, torej: bolj nestabilna spojina, večja je sproščena energija, predstavljena kot -ΔH. Negativni simbol pomeni, da toplota izteče.
Za primerjavo relativne stabilnosti med različnimi alkami in njihovimi izomeri se uporabljajo različne vrednosti -ΔH. Omogoča tudi stabilen.
Meritev
Za merjenje ogrevanja zgorevanja je potrebna kalorimetrična črpalka. Znotraj njega snov reagira s kisikom z aktiviranjem električne iskre.
Nato sproščena toplota segreva prostornino vode, ki obdaja vzorčni predal, pri čemer meri temperaturo pred in po izgorevanju, pa tudi maso vode in goriva.
Torej, sproščena energija bo enaka:
CEH2O·mH2Ali · Δt
KjeEH2O To je specifična toplota vode, 4.184 J/G · ºC, mH2Ali maso vode in Δt njeno temperaturno spremembo. Nazadnje je ta toplota, izražena v enitah Joule ali kalorij, razdeljena med maso ali moli goriva, nameščene znotraj kalorimetrične črpalke, da dobimo toploto zgorevanja na enoto mase ali molov.
Vam lahko služi: kaj je mehanski ekvivalent toplote?Kovine se ne združujejo, ampak oksidirajo z različnimi hitrostmi, odvisno od temperature, pri kateri so izpostavljene. Toplota, ki jo proizvajajo. Zato niso gorljive snovi.
Potencialne energije
Med zgorevanjem so povezave porušene, da tvorijo nove, bolj stabilne. Energija, ki jo vsebuje vse molekulske povezave, je neodvisna od njegovega gibanja, zato obstaja potencialna energija.
Večja kot je potencialna energija, molekula bo bolj nestabilna, zato bo sprostila več toplote, ko bodo vzpostavljene nove povezave.
Če želite vedeti, katere točno so te nove povezave, je treba upoštevati izdelke popolnega izgorevanja: CO2 Za ogljik, h2Ali za vodik in ne2 Za dušik. V zvezi z ogljikovodiki bo njihovo popolno zgorevanje ustvarilo stehiometrične mešanice CO2 in h2Tudi.
Obe molekuli, co2 in h2Ali pa imajo zelo majhne potencialne energije, ker so njihove povezave (o = c = o in h-o-h) zelo stabilne v primerjavi s povezavami ogljikovodikov, od katerih sta prišla (C-H in C-C).
Relativna stabilnost
Potencialne energije so prosto. Toda njihove različice niso, to je razlika v teh energijah med izdelki (CO2 in h2O) in reaktanti (ogljikovodiki).
Zato lahko te različice ali kaj je enako, njihovo zgorevanje se ogreje, lahko veste, kakšna je relativna stabilnost med naborom ogljikovodikov ali izomerov.
Zapre
Alkani so lahko linearni, razvejani ali ciklični. V primeru linearnih alkanov se njegova toplota zgorevanja razlikuje glede na dolžino verig; Se pravi, odvisno od tega, koliko enot ch2 imeti. Razmislite o primeru n-heksan, n-heptano in n-Octane:
Lahko vam služi: jod: zgodovina, lastnosti, struktura, pridobivanje, tveganje, uporabePogl3(Pogl2)4Pogl3, -ΔH = 4163 kJ/mol
Pogl3(Pogl2)5Pogl3, -ΔH = 4817 kJ/mol
Pogl3(Pogl2)6Pogl3, -ΔH = 5471 kJ/mol
Vidite, da se njegove zgorevanja toplote razlikujejo za 654 kJ/mol. To pomeni, da vsak Cho2 ki je dodana verigi, poveča toploto zgorevanja s hitrostjo 654 kJ/mol. Tako, nonano, ch3(Pogl2)7Pogl3, Ima toploto zgorevanja, ki je enaka 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
To je isto, kot da imajo daljše verige večje potencialne energije, zato so bolj nestabilne.
Ramificirani alkani so bolj stabilni kot linearni in to je razvidno iz njihovih ogrevanja zgorevanja. Upoštevajte zdaj primer treh izomerov oktana:
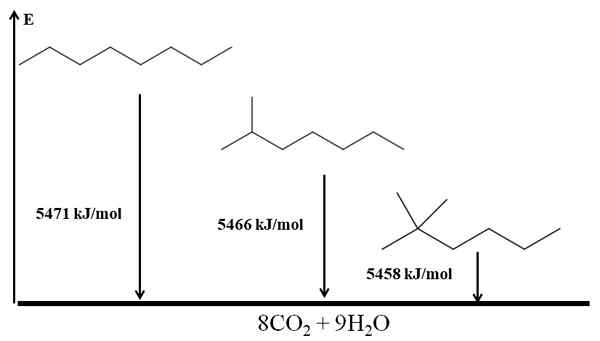 Izgorevanje segreva za tri oktanske izomere. Vir: Gabriel Bolívar prek Molview.
Izgorevanje segreva za tri oktanske izomere. Vir: Gabriel Bolívar prek Molview. On n-Octano je najbolj nestabilen, saj je njegova toplota zgorevanja največja (5471 kJ/mol). Po drugi strani pa izomeri 2-metilheptano in 2,2-dimetilheksan. 2,2-dimetilheksan je najbolj stabilen za to, da je najbolj razvejan od treh izomerov.
Alkeni
Relativna stabilnost alkenov je mogoče dobiti tudi iz njihovih ogrevanja zgorevanja. Razmislite na primer štiri izomere butenusa:
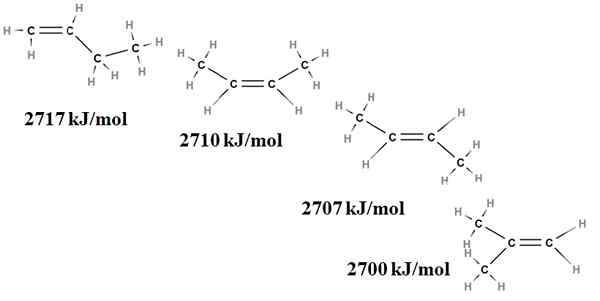 Izgorevanje segreva za izomere butno. Vir: Gabriel Bolívar prek Molview.
Izgorevanje segreva za izomere butno. Vir: Gabriel Bolívar prek Molview. Tu ne govorimo več o posledicah, ampak o stopnji zamenjave dvojne vezi, c = c in njenih napetosti van der Waals; to je iz elektronskih in steričnih odbojnosti med dvema obsežnima skupinama, ki se nahajata na isti strani dvojne vezi.
Prvi izomer, 1-buten, je najbolj nestabilen, ker je njegova dvojna vez manj zamenjana (h2C = C). To se odraža v njegovi zgorevalni toploti 2717 kJ/mol.
Vam lahko služi: klorogena kislinaNa desni je CIS-2-buten nekoliko bolj stabilen, ker je njegova dvojna vez bolj zamenjana. Toda Trans-2-buten je še bolj, saj tudi, če ima enako stopnjo zamenjave, skupine zbirajo3 dvojne vezi so v trans položajih, torej na različnih straneh dvojne vezi. Upoštevajte, da je toplota trans-2-butena (2707 kJ/mol) komaj nekoliko nižja kot pri cis-2-butenu (2710 kJ/mol).
Zadnji izomer, 2-metil-2-buten, ki je enako nadomeščen tudi kot CIS in Trans 2 Bungeo, je kljub temu najbolj nestabilen od vseh. To je zato, ker oba Ch3 Najdemo jih v enem od ogljikov dvojne vezi, zato so alkene s Cho3 Dragulji.
Karbonilne spojine
Poleg alkosov in drugih ogljikovodikov na splošno je relativna stabilnost karbonilnih spojin (ketoni, aldehidi, karboksilne kisline) povezana tudi z njihovimi ogrevanji zgorevanja.
Tako bodo bolj stabilizirani ali manj reaktivni njihovi skupini c = o, mladoletniki bodo njihove zgorevanja.
Na primer toplota zgorevanja butanala, ch3Pogl2Pogl2Cho, 2475 kJ/mol. Ta toplota je višja od 2-butanona, ch3Pogl2Coch3, ki je enak 2442 kJ/mol. Zato je butanal bolj nestabilen kot 2-butanon.
V 2-butanonu je C = O bolj stabiliziran zahvaljujoč skupinam CH3Pogl2 in pogl3; Stvar, ki se ne zgodi z butanom, kjer je ena od skupin komaj atom h.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Toplota zgorevanja. Pridobljeno iz: v.Wikipedija.org
- Fundacija CK-12. Toplota zgorevanja. Kemija librettexts. Okrevano od: kem.Librettexts.org
- BBC. (2020). Kemična energija: entalpija zgorevanja. Pridobljeno iz: BBC.co.Združeno kraljestvo
- Steven a. Hardinger. (2017). Ilustrirani slovar organske kemije: entalpija zgorevanja. Okrevano od: kem.UCLA.Edu

