Struktura natrijevega borohidrida (NABH4), lastnosti, uporabe

- 3739
- 1068
- Barry Ernser
On Natrijev boron To je anorganska trdna snov, katere kemična formula je NABH4. Lahko se šteje. Je kristalno bela trdna snov.
Po stiku z vodo NABH4 lahko ustvari toploto in vodik h2 ki je gorivo, zato ga je treba ravnati previdno. Za lahkotnost, s katero lahko ustvari hidridne ione h-, Natrijev boron je zmerno reducirajoča spojina, zato se v ta namen pogosto uporablja v kemičnih reakcijah.
 Natrijev borohidrid, Nabh4, trden. Ondřej mangl [javna domena]. Vir: Wikimedia Commons.
Natrijev borohidrid, Nabh4, trden. Ondřej mangl [javna domena]. Vir: Wikimedia Commons. Njegova zmanjšanja lastnosti se uporablja tudi v papirni industriji, saj omogoča izboljšanje značilnosti svetlosti in stabilnosti celuloze in papirja, ko deluje proti oksidaciji celuloze, glavni sestavni del papirja.
Ker v prisotnosti vode zlahka tvori vodik, je bila raziskana tudi možnost uporabe kot reverzibilnega vira vodika v gorivnih celicah.
Druge uporabe imajo vse na podlagi svoje zmanjševanja, na primer v farmacevtski industriji.
[TOC]
Struktura
Natrijev boron je ionska spojina. Tvori ga borohidrid anion [bh4]- skupaj z natrijevim na kationu+.
Anion [bh4]- Je tetraedra.
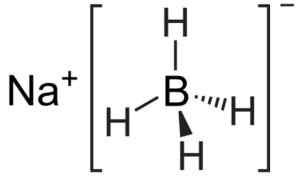 Natrijeva borohidridna struktura. Kemikungen [javna domena]. Vir: Wikimedia Commons.
Natrijeva borohidridna struktura. Kemikungen [javna domena]. Vir: Wikimedia Commons. Njegova struktura Lewisa je naslednja:
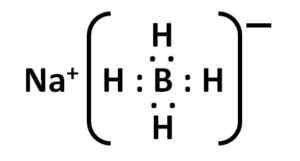 Nabh lewis elektronska struktura4. Avtor: Marilú Stea.
Nabh lewis elektronska struktura4. Avtor: Marilú Stea. Nomenklatura
-Natrijev boron
-Natrijev tetrahidroat
-Natrijev tetrahydrurorat
Fizične lastnosti
Fizično stanje
Kristalno bela trdna trdna snov.
Molekularna teža
37,84 g/mol
Temperatura samostojnosti
∼ 220 ° C
Temperatura razgradnje
> 250 ° C
Gostota
1.074 g/cm3 pri 20 ° C
Vam lahko služi: Grignard reagent: priprava, aplikacije, primeriTopnost
Nabh4 V vodi je precej topen (55 g/100 ml pri 25 ° C), kjer delno hidrolizira. V tetrahidrofurano (thf) je topen in je netopna v dietični eter.
Kemične lastnosti
Natrijev boron se raztopi v vodi, kjer trpi začetno razgradnjo ali hidrolizo, zaradi katere je raztopina osnovna, kar preprečuje poznejšo hidrolizo.
[BH4]- + H2O → B (OH)3 + H2↑ + OH-
To je razloženo, ker [bh4]- interakcijo s h+ Vode, kjer je h+ Vzemite hidrid H anion- Oblikovati h2. Lahko rečemo, da je BH3 Konkurira s H+ Za hidrid h-.
V kislem mediju je hidroliza končana zaradi številčnosti H ionov+.
Nabh4 Je stabilen v suhem zraku. Ni nestanovitna.
Natrijev boron je zaradi vsebnosti hidridnih ionov reducirna spojina. Omogoča zmanjšanje karbonilne skupine C = o C-OH, to je karbonilne spojine za alkohole.
Nabh4 Sama po sebi ne zmanjšuje dvojnih vezi c = c, niti konjugatov s karbonilnimi skupinami -C = c -c (= o)-.
Vendar pa pri stiku s protonskimi kislinami (na primer HCl) ali Lewisovo kislino (na primer BCL3 ali alcl3) Diborano B je oblikovan2H6. In če se ta reakcija izvede v prisotnosti organskih spojin z dvojnimi vezmi c = c diborano B2H6 Izvaja hidrobacioniranje teh.
Ob prisotnosti ustreznih katalizatorjev in specifičnih pogojev lahko natrijev boron zmanjša različne vrste funkcionalnih skupin.
Tveganja
Toplota reakcije hidrolize v vodi je dovolj, da vklopi vodik, ki nastane v njem. Zato je pomembno biti previden pri manipuliranju.
Nabh4 Je enostavno vklopljen in ga je enostavno zažgati.
Pridobivanje
Tipična reakcija priprave NABH4 Je skozi natrijev hidrid NAH in B (och3)3 Pri temperaturi približno 250 ° C:
Lahko vam služi: vodna elektroliza4 NaH + B (Och3)3 → NABH4 + 3 Naoch3
Prijave
V kemičnih reakcijah zmanjšanja
Ker je vir hones h-, Nabh4 Je reducirajoča spojina in se uporablja za pripravo drugih kemičnih spojin. Če želite to narediti, se uporablja v apratotičnih polarnih topilih, torej brez H protonov+, kot so dimetilsulfoksid, heksametilfosforalni in dimetiloformamid.
Uporablja se kot redukcijsko sredstvo tako v reakcijah organske kot anorganske kemije.
Omogoča zmanjšanje aldehida na primarne alkohole in ketone na sekundarne alkohole.
Prav tako zmanjšuje alkilne halogenide na ogljikovodike, kot je jododan na Dean.
Če deluje sam, pri zmanjšanju ne vpliva.
Njegova lastnost ne zmanjšuje dvojnih vezi c = C, niti konjugati s karbonilnimi skupinami -C = C-C (= O)-vam omogoča pripravo nenasičenih alkoholov -c = c-ch2-Oh.
Za zmanjšanje aromatičnih spojin nitrados na ustrezne aniline zahteva prisotnost katalizatorjev, kot sta kobalt klorid ali kositer. Zmanjšajte disulfide na tiole.
V prisotnosti ustreznih pogojev in katalizatorjev omogoča zmanjšanje karboksilnih kislin, estrov, sredin, nitril, imina, epoksidov in celo dvojnih in trojnih vezi.
V h2 V gorivnih celicah
Nabh4 Lahko ga spremenimo v gorivno celico.
Nabh4 V prisotnosti alkalne raztopine Koh ali NaOH je hidroliziran in proizvaja vodik H2 ki se lahko uporablja kot gorivo v polimerni elektrolitni bateriji za gorivo.
Raziskali so ga tudi kot H material za H shranjevanje H2 reverzibilno.
Nanodelci NABH so sintetizirani4 in stabilizirajo s površinsko aktivno sredstvo. Po zdravljenju z NICL2 Nastavljen je zaščitni sloj ali prevleka, ki ureja sproščanje H2 popolnoma reverzibilno.
Lahko vam služi: Srebrni nitrat (Agno3): struktura, lastnosti, uporabe, strupenostTa nov nanometrični material bi omogočil uporabo H2 Kot čisto in obnovljivo gorivo.
 Vozilo, ki deluje z vodikovo gorivno celico. Doktor. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Vozilo, ki deluje z vodikovo gorivno celico. Doktor. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. V industriji celuloze in papirja
Natrijev boron se uporablja za izboljšanje svetlosti in drugih fizikalnih lastnosti celuloze in papirja.
Razgradnja celulozne matrice papirja se pojavi s kompleksnimi procesi, ki vključujejo oksidacijo. Hidroksilne skupine oksidirajo karbonil in karboksil, kar vodi do razbarvanja papirja in zmanjšanih fizikalnih lastnosti.
Pri zdravljenju celuloze ali papirja z NABH4, To zmanjšuje aldehido in ketone v skupine -OH, ne da bi vplivalo na kislinske karboksilne skupine, izboljšalo stabilnost in svetlost na vrednosti, večje od začetnic.
 Nabh4 omogoča izboljšanje svetlosti papirja. Avtor: Rawpixel. Vir: Pixabay.
Nabh4 omogoča izboljšanje svetlosti papirja. Avtor: Rawpixel. Vir: Pixabay. V več uporabi
Natrijev boron se uporablja za obdelavo odpadne vode, kot nepravilno sredstvo za okus v industriji hrane in pijač, kot sredstvo za prevleko in za obdelavo površin, pri proizvodnji tobaka, v farmacevtski, tekstilni in tekstilni industriji.
Reference
- Christian, m.L. in aguey-znsou, k.-F. (2012). Strategija jedrne lupine, ki vodi do visoke reverzibilne zmogljivosti za shranjevanje vodika za NABH4. ACS Nano 2012, 6, 9, 7739-7751. Okrevani iz lokalov.Acs.org.
- Nora de Souza, m.V. in Alves v., T.R. (2006). Nedavne metodologije, posredovane z natrijevim borohidridom pri redukciji različnih razredov spojin. APP. Organometal. Kem. 2006; 20: 798-810. Pridobljeno iz spletne knjižnice.Wiley.com.
- Imamoto, t. (1991). Zmanjšanje. Natrijev borohidrid. Pri razumevanju organske sinteze. Okrevano od Scientirect.com.
- Tang, l.C. (1986) Stabilizacija papirja z zdravljenjem z natrijevim borohidridom. V zgodovinskem tekstilnem in papirnem gradivu. Poglavje 24. Strani 427-441. Napredek v kemiji, letnik 212. Okrevani iz lokalov.Acs.org.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Morrison, Robert Thornton; in Boyd, Robert Neilson. 1992. Organska kemija. Prentice-Hall. ISBN 81-203-0765-8.
- Ali.S. Nacionalna knjižnica medicine. (2019). Natrijev borohidrid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- « Značilnosti in primeri družbenih pojavov
- Kobalt klorid (COCL2 (struktura, nomenklatura, lastnosti »

