Zgodovina, lastnosti, struktura, uporabe

- 988
- 278
- Ricky Dach
On boron To je nemetalni element, ki vodi skupino 13 periodične tabele in je predstavljen s kemičnim simbolom B. Njegova atomska številka je 5 in je edini nemetalni element v njegovi skupini; Čeprav nekatere kemikalije menijo, da je to metaloid.
Predstavljen je kot črni rjavi prah in je v 10 ppm v zvezi z zemeljsko skorjo. Zato ni eden najpogostejših elementov.
 Vzorec boro s čistostjo okoli 99%. Vir: alajhasha [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Vzorec boro s čistostjo okoli 99%. Vir: alajhasha [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Je del več mineralov, kot sta borax ali natrijev borat, kar je najpogostejši mineral bora. Obstajajo tudi Kurnite, še ena oblika natrijevega borerata; Colemanit ali kalcijev borat; in uleksit, natrij in kalcij borato.
Boratos izvlečemo v ZDA, Tibetu, na Kitajskem in v Čilu s svetovno produkcijo približno dve milijoni ton na leto.
Ta element ima trinajst izotopov, ki so najpogostejši enajstB, ki predstavlja 80,1% bora in 10B, ki tvori preostalih 19,9%.
BORO je bistvena sled za rastline, ki posega v sintezo nekaterih vitalnih rastlinskih beljakovin in prispeva k absorpciji vode. Pri sesalcih se zdi potrebno za zdravje kosti.
Čeprav sta boro leta 1808 odkrila angleški kemik sir Humphry Davy in francoski kemiki Jacques Thérnard in Joseph Gay-Lussac, od začetka naše dobe na Kitajskem je bil uporabljen Borax v izdelavi lončarstva emajla.
BORO in njegove spojine imajo številne uporabe in aplikacije, od njihove uporabe pri ohranjanju hrane, zlasti margarine in rib, do uporabe pri zdravljenju rakavih tumorjev možganov, mehurja, prostate in drugih organov ter drugih organov ter drugih organov.
Boron ni zelo topen v vodi, vendar so njene spojine. To je lahko koncentracijski mehanizem bora in vir zastrupitve z elementom.
[TOC]
Zgodovina
Ozadje
Ker je oddaljeni Times človek uporabljal boronske spojine v različnih dejavnostih. El Borax, mineral, znan kot Tincal, je bil na Kitajskem uporabljen leta 300 d leto.C. V izdelavi emajlne keramike.
Perzijski alkimist (865–925) je prvo omenil spojine Boro. Rhazes je v šestih razredih razvrstil minerale, eden od njih pa so bili Borociji, ki so bili vključeni.
Agricola, okoli leta 1600, je poročala o uporabi Boraxa kot toka v metalurgiji. Leta 1777 je bila prepoznana prisotnost borove kisline v toku vročih vzmeti v bližini Firence.
Odkritje elementa
Humphry Davy je z elektrolizo raztopine boraksa opazil kopičenje črne oborine v eni od elektrod. Ogrel je tudi boronski oksid (B2Tudi3) S kalijem, ki proizvaja črno rjavo prah, ki je bila znana oblika bora.
Gay-Lussac in Thénard sta pri visokih temperaturah v prisotnosti železa za proizvodnjo bora zmanjšala borovo kislino. Pokazali so tudi obratni postopek, to je, kjer je borna kislina produkt oksidacije bora.
Identifikacija in izolacija
Jöns Jakob Berzelius (1827) je identifikacijo Bora dosegel kot nov element. Leta 1892 je francoski kemik Henri Moissan uspel izdelati boro z 98% čistostjo. Čeprav je poudarjeno, da je leta 1909 izdelal zgolj ameriški kemik Ezekiel Weintraub.
Lastnosti
Fizični opis
Kristalni trden ali črno rjav amorfni prah.
Vam lahko služi: peroksidi: lastnosti, nomenklatura, uporabe, primeriMolarna masa
10,821 g/mol.
Tališče
2076 ° C.
Vrelišče
3927 ° C.
Gostota
-Tekočina: 2,08 g/cm3.
-Kristalni in amorfni pri 20 ° C: 2,34 g/cm3.
Fuzijska toplota
50,2 kJ/mol.
Toplota za uparjanje
508 kJ/mol.
Molarna kalorična sposobnost
enajst.087 J/(mol · k)
Ionizacijska energija
-Prva raven: 800.6 kJ/mol.
-Druga stopnja: 2.427 kJ/mol.
-Tretja stopnja: 3.659,7 kJ/mol.
Elektronegativnost
2.04 na lestvici Pauling.
Atomski radio
21.00 (empirično).
Atomski volumen
4,16 cm3/mol.
Toplotna prevodnost
27,4 w/m.K
Električna upornost
~ 106 Ω.M (pri 20 ° C).
Visok temperatur boron je dober električni prevodnik, toda pri temperaturi okolice postane skoraj izolator.
Trdota
~ 9.5 na lestvici MOHS.
Reaktivnost
Klorovodikova kislina pri vrelišču ne vpliva na boro. Vendar pa ga pretvori vroča dušikova kislina v borovo kislino (h3BO3). Boro se kemično obnaša kot ne -kometal.
Reagira z vsemi halogeni, da daje trihaluros, zelo reaktiven. Te imajo splošno formulo BX3, Kjer x predstavlja halogen.
Kombinirano je z več elementi, da izvirajo Boruros. Nekateri od njih so med snovmi večje trdote; Na primer, boron nitrid (BN). Boron je kombiniran s kisikom, da tvori bonski trioksid.
Elektronska struktura in konfiguracija bora
Povezave in strukturne enote v bonu
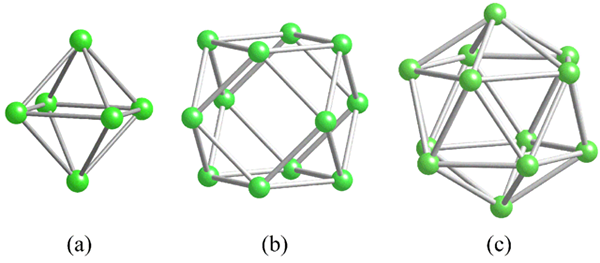 Geometrije skupnih strukturnih enot za boro. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Geometrije skupnih strukturnih enot za boro. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Preden naslavljamo boronske strukture (kristalne ali amorfne), je treba upoštevati, kako lahko njihove atome povežemo. Povezava B-B je v kovalentnem bistvu; Ne samo to, ampak zato, ker imajo seveda atomi boro elektronsko pomanjkanje, ga bodo tako ali drugače poskušali dobaviti v svojih povezavah.
V bonu je posebna vrsta kovalentne vezi: tista treh centrov in dveh elektronov, 3C2E. Tu trije atomi delijo dva elektrona in definirajo trikotnik, enega izmed številnih obrazov, ki jih najdemo v njihovih strukturnih polihedroh (vrhunska slika).
Od leve proti desni imamo: oktaedro (a, b6), Cuboctaedro (B, B12) In Isocasedro (C, B12 tudi). Vse te enote imajo značilnost: v elektroni so slabi. Zato se morajo kovalentno povezati med seboj; In rezultat je presenetljiva povezava.
V vsakem trikotniku teh polihedrov je prisotna povezava 3C2E. V nasprotnem primeru ni bilo mogoče razložiti, kako lahko v teh poliedrskih enotah do pet povezav v teh poliedrskih enotah do pet povezav oblikuje samo tri kovalentne vezi po teoriji povezav Valencia.
Strukture bora so nato sestavljene iz ureditve in ponavljanja teh enot, ki na koncu določijo kristal (ali amorfno trdno).
Boro α-romboédrico
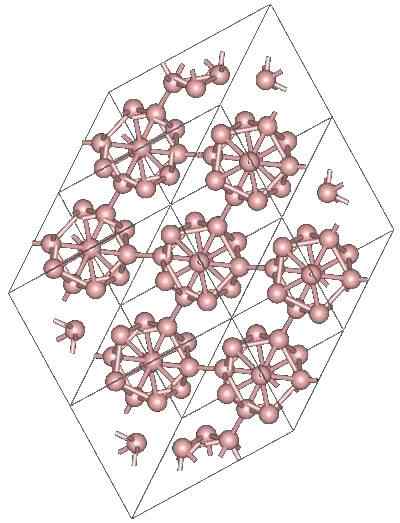 Kristalna struktura alotropskega bora α-romboédrico. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Kristalna struktura alotropskega bora α-romboédrico. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Obstajajo lahko druge poliedrske enote Boro, pa tudi spojina le dva atoma, b2; boronska "linija", ki mora biti povezana z drugimi atomi po njegovem visokem elektronskem pomanjkanju.
Icosaedro je daleč najprimernejša enotnost bora; Tisti, ki se počuti bolje. Na zgornji sliki je na primer cenjeno, kako te B enote12 Prepletajo se, da definirajo romboedralni kristal bora-α.
Če bi bil eden od teh ikosaedrov izoliran, bi bila to zapletena naloga, saj jih njihovo elektronsko pomanjkanje prisili, da določijo kristal, kjer vsak zagotavlja elektrone, ki jih potrebujejo drugi sosedje.
Β-romboédrico boron
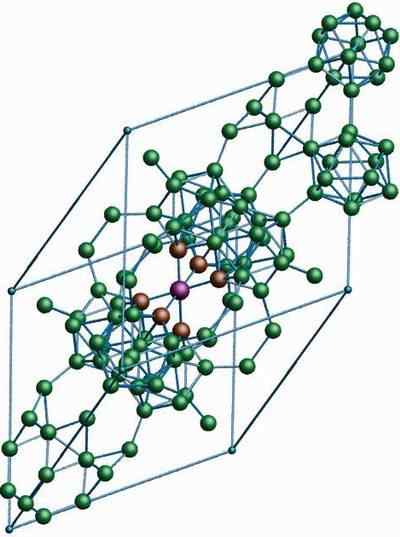 Kristalna struktura β-romboédrico bora alotropna. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Kristalna struktura β-romboédrico bora alotropna. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Alotropski β-romboédrico boron, kot že ime že ime, ima kristale Rhomboédica in tudi boron-α; Vendar se razlikuje v svojih strukturnih enotah. Videti je kot nezemeljska ladja, narejena z atomi bora.
Lahko vam služi: litijev hidroksid (LIOH)Če lahko natančno vidite ikozahedrične enote na diskreten in združeni način (v središču). Obstajajo tudi B enote10 in osamljeni atomi, ki delujejo kot most za prej omenjene enote. Od vsega je to najbolj stabilen alotrop bora.
BORO-γ dragulj
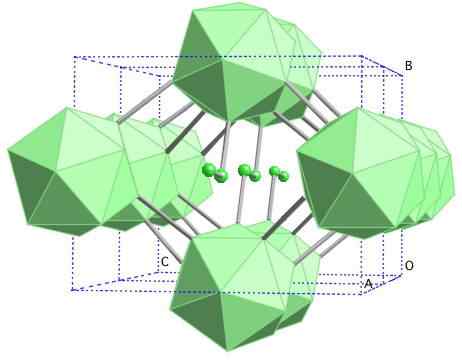 Kristalna struktura bora-γ. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Kristalna struktura bora-γ. Vir: MaterialScientist pri angleški Wikipediji [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] V tem boronu so enote B usklajene2 in b12. B2 predstavlja toliko elektronskega pomanjkanja, da dejansko odstrani elektrone iz B12 In v tej trdni trdni trdni trdni snovi je torej ionski značaj. Se pravi, ne le, da so kovalentno združeni, ampak obstaja elektrostatična privlačnost tipa [B2-] [B12+].
Boro-γ kristalizira v strukturi soli drage, enako kot za NACL. Pridobljeni so drugi alotropi od bora do visokih tlakov (20 GPa) in temperature (1800 ° C), nato pa ostanejo stabilni v normalnih pogojih. Njegova dejanska stabilnost tekmuje z β-romboédrico bora.
Kubični in amorfni
Drugi alotropi bora so sestavljeni iz agregatov atomov B, kot da bi jih združili kovinska vez, ali kot da so ionski kristali; to pomeni, da je kubični boron.
Nenazadnje je tudi amorfni boron, čigar razporeditev B enot12 Je naključno in zmedeno. Predstavljen je kot lep ali stekleni prah temnih barv in neprozorna rjava.
Borofenos
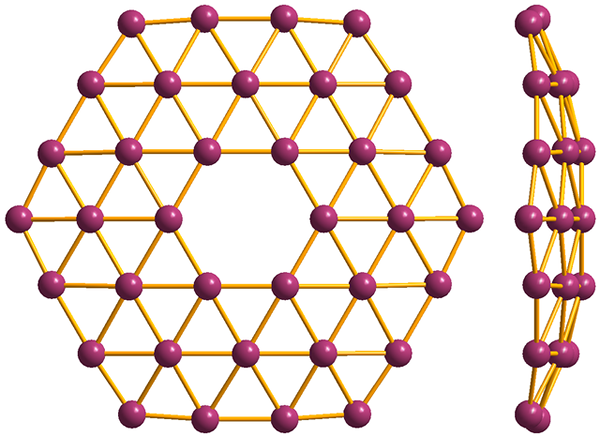 Struktura najpreprostejšega Borofenosa, B36. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Struktura najpreprostejšega Borofenosa, B36. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] In končno je najbolj nov in bizaren alotropski Boro: Borofenos (višja slika). Sestavljen je iz opične plasti atomov bora; izjemno tanek in analogen grafenu. Upoštevajte, da ohranja znane trikotnike, značilne za elektronsko pomanjkanje, ki ga trpijo njegovi atomi.
Poleg borofenosa, od katerih je B36 Je najpreprostejši in majhen, obstajajo tudi Borovi grozdi. Borosferen (slika spodaj) je sestavljena iz sferične kletke, podobne kroglici štirideset atomov Boro, B40; Toda namesto da bi imeli gladke robove, so nenadni in nepravilni:
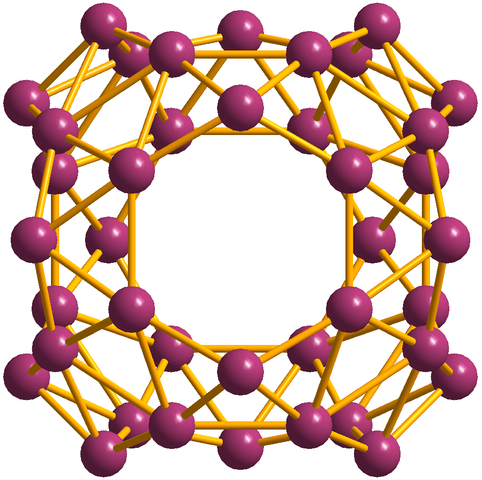 Enota Borosferenos, B40. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Enota Borosferenos, B40. Vir: MaterialScientist [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Elektronska konfiguracija
Elektronska konfiguracija bora je:
[On] 2s2 2 p1
Zato tri elektrone iz Valencije. Primanjkuje mu še pet, da bi dokončal svoj okteto iz Valencije in komaj oblikuje tri kovalentne vezi; Za dokončanje vašega okteta bi potreboval četrto povezavo. Boron lahko izgubi svoje tri elektrone, da pridobi stanje oksidacije +3.
Pridobivanje
BORO je izoliran z zmanjšanjem borove kisline z magnezijem ali aluminijem; Metoda, podobna Gay-Lussac in Thénard. Ima težave zaradi onesnaževanja z boronom z Borurosom teh kovin.
Vzorec visoke čistosti lahko dobimo z plinasto redukcijo borovega triklorida ali tribromida, z vodikom na električno tantrično ogrevanih nitkah.
Boron z visoko čistostjo pripravimo z razgradnjo pri visokih diboranovih temperaturah, čemur sledi čiščenje z zlitjem cone ali Czocharalski procesov.
Prijave
V industriji
Elementarni boron je bil uporabljen pri utrjevanju jekla. V zlitini z železo, ki vsebuje med 0,001 in 0,005 %. Uporablja se tudi v industriji, ki ni na voljo, običajno kot deoksidant.
Poleg tega se boro uporablja kot blatni v bakrenih zlitinah in baker z visoko prevodnostjo. V polprevodniški industriji se dodajo majhne količine boro.
Vam lahko služi: izopreno: struktura, lastnosti, aplikacijeBoro oksid (b2Tudi3) se meša s silicijevim dioksidom, da naredi toplotno odporno steklo (borozilatno steklo), ki se uporablja v kuhinjskih pripomočkih in določeni laboratorijski opremi.
Boro karbide (b4C) To je izjemno trda snov, ki se uporablja kot abrazivno in ojačitveno sredstvo v sestavljenih materialih. Aluminij boruro (alb12) Uporablja se kot diamantni nadomestek prahu za zmrznjene in polirane.
BORO se uporablja v zlitinah, na primer v redkih zemeljskih magnetih, zlitin z železom in neodimijem. Oblikovani magneti se uporabljajo pri izdelavi mikrofonov, magnetnih stikal, slušalk in pospeševalnikov delcev.
V medicini
Zmogljivost izotopa BOO-10 (10B) Za ulov nevtronov je bilo za zdravljenje možganskih tumorjev uporabljeno oddajanje sevanja α v tehniki, znani kot terapija za zajem nevtronskih nevtronov (BNCT).
On 10B v obliki spojin se nabere v rakavem tumorju. Nato se seva tumorska cona z nevtroni. Ti delujejo 10B, kaj povzroča emisije α delcev. Ti delci imajo visok relativni biološki učinek in zaradi velike velikosti imajo majhen doseg.
Torej je uničevalno delovanje α delcev omejeno v tumorskih celicah, ki izvajajo njihovo uničenje. BNCT se uporablja tudi pri zdravljenju tumorjev vratu, jeter, mehurja in prostate.
Biološko delovanje
Za rast številnih rastlin je potrebna majhna količina borove kisline ali borerata. Pomanjkanje bora se kaže pri deformirani rasti rastlin; "rjavo srce" zelenjave; in "suha gniloba" sladkorne pese.
Za ohranitev zdravja kosti je morda potreben boron v majhnih količinah. Obstajajo študije, ki kažejo, da bi bilo pomanjkanje bora vključeno v nastajanje artritisa. Prav tako bi posegalo v možganske funkcije, kot sta spomin in koordinacijski človek.
Nekateri strokovnjaki poudarjajo, da je treba v dnevno prehrano vključiti 1,5 do 3 mg bora.
Tveganja in previdnost
Boron, bonski oksid, borova kislina in boratos, veljajo za netoksične. LD50 za živali je 6 g bora/kg telesne teže, medtem ko snovi z LD50, večjimi od 2 g/kg telesne teže.
Po drugi strani poraba več kot 0,5 mg/bora za 50 dni povzroči manjše prebavne težave, kar kaže na strupenost. Nekatera poročila poudarjajo, da lahko presežek vnosa bora vpliva na delovanje želodca, jeter, ledvic in možganov.
Prav tako so bili v nazofarinksu, zgornjem dihalnem traktu in oči za izpostavljenost boronu navedeni kratkoročni dražilni učinki.
Poročila o toksičnosti bora je malo in v mnogih primerih je strupenost predstavljena pri zelo visokih odmerkih, višja od splošne populacije je izpostavljena.
Priporočilo je spremljati vsebnost bora v hrani, zlasti zelenjavo in sadjem. Vladne zdravstvene agencije morajo spremljati, da koncentracija vodnih borov ne presega dovoljenih omejitev.
Delavci, ki so izpostavljeni prahu, ki vsebuje boro, bi morali nositi maske, ki ščitijo dihalne trakte, rokavice in posebne škornje.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Alotropi iz bora. Pridobljeno iz: v.Wikipedija.org
- Prof. Robert J. Lancashire. (2014). Predavanje 5b. Struktura elementov (Non-Metals, B, C). Oddelek za kemijo, Univerza v Zahodni Indiji, kampus Mona, Kingston 7, Jamajka. Okrevano od: kem.Uwimona.Edu.Jm
- Manisha Lalloo. (28. januar 2009). Odkrita struktura ultra-pure bora. Kemijski svet. Okrevano od: ChemistryWorld.com
- Bell Terence. (16. december 2018). Profil kovinskega bora. Okreval od: uravnoteženosti.com
- Uredniki Enyclopeedia Britannica. (2019). Boron. Okrevano od: Britannica.com
- Agencija za strupene snovi in register bolezni. (2010). Toxfaqs ™ na boronu. [PDF]. Pridobljeno iz: atsdr.CDC.Gov
- Čelada, Anne Marie, ph.D. (6. februar 2019). Boronske kemijske in fizikalne lastnosti. Okreval od: Thoughtco.com

