Struktura kalijevega biftalata, nomenklatura, uporabe, tveganja
- 3819
- 1152
- Ignacio Barrows
On kalijev biftalat Je kemična, trdna, bela, topna spojina, ki je komercialno v stanju visoke čistosti. Uporablja se kot primarni vzorec za standardizacijo rešitev v kvalifikacijah za kislino; Uporablja se tudi kot puferska raztopina, da pH raztopin ohranja stabilen.
Gre za stabilno, ne -higroskopsko spojino, ki olajša pripravo raztopine, saj med težkim postopkom ne absorbira vode. Pripravimo ga lahko z reakcijo med fotolsko kislino in raztopino KOH, pri kateri vodik molekule ftalne kisline nadomesti s kalijevim atomom.
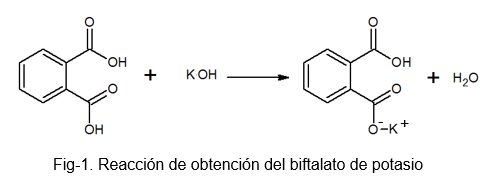
Kalijev biftalat prejme to ime, ker je v svoji molekuli rahlo kisli vodik. Ta vodik je tisti, ki ga najdemo v skupini -OH, ki se nahaja tik ob karbonilni skupini, ki je del karboksila, ki ne reagira. Ta vrsta soli so znana kot kisle soli, saj niso popolnoma nevtralne.
[TOC]
Kemična struktura

Formula
C6H4Coohcook = c8H5 Ko4
Nomenklatura
- Kalijev biftalat.
- Ftalat kalijeve kisline.
- Kalijev hidrogenoftalat.
Lastnosti
Gostota
1.636 g/ml.
Molarna masa
204.22 g/mol.
Topnost
Voda in alkohol.
Tališče
295 ° C z razpadom.
Vidik
Bela -bela trdna.
Specifična teža
1,64 gr/cm3.
Študija derivata kalijevega biftalata
Derihrografske meritve so pokazale, da se razgradnja kalijevega biftalata začne med 190 ° C in 200 ° C, ne -higroskopska priprava pa lahko pripravimo med 100 ° C in 150 ° C.
Razkroj poteka v treh korakih, katerih hitrost je odvisna od hitrosti pri zvišanju temperature: najprej nastane dipbotassijev ftalat, ftalični anhidrid in voda se izloči.
Vam lahko služi: kalcijev klorid (cacl2)Spremembe entalpía lahko dobite tudi iz derivata, to daje informacije o dodatnem mehanizmu toplotnega razgradnje in spremembah stanja vzorca.
Uporaba in aplikacije
Ta spojina se uporablja pri analitični kemiji pri titraciji ali oceni kisline kot primarni vzorec za standardizacijo pri pripravi raztopin iz različnih spojin.
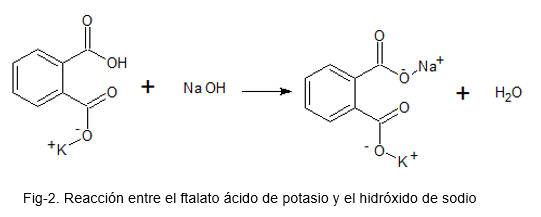
Standardizacija baze (alkali = NaOH)
Pri pripravi raztopine NaOH ni mogoče zagotoviti, da je koncentracija, s katero ostane rešitev, pravilna; To je zato, ker je NaOH zelo higroskopska trdna snov (absorbira zrak iz zraka) in da ga tehtamo z nekaj vlage, zaradi česar količina snovi ni najbolj optimalna.
Ko je rešitev pripravljena, je treba natančno vedeti, kakšno koncentracijo je ostalo.
Za to se raztopina pripravi s ftalatom kalijeve kisline, ki je primarni vzorec (zaradi njegove visoke stabilnosti); Dodamo nekaj kapljic indikatorja baze kisline s fenolftalein in raztopino NaOH kot naslov, dokler se v raztopini ftalata s kalijevo kislino ne zadrži rožnate barve.
S pridobljenimi podatki se ustrezni izračuni izvedejo za iskanje resnične koncentracije NaOH.
Naslednja slika ponazarja kemijsko reakcijo med ftalatom kalijeve kisline in natrijevim hidroksidom.

Kot puferska raztopina pri določanju pH
Raztopina pufra ali pufra je tista, ki jo tvorita kislina in kislina sol, zaradi česar ostane v pogojih, tako da se pH vrednost ne spremeni, ko se dodajo majhne količine kisline ali baze.
Vam lahko služi: gravimetrija: gravimetrična analiza, metode, uporabe in primeriTveganja
- Požarna izpostavljenost. Kot pri večini organskih trdnih snovi je mogoče, da se lahko pojavi ogenj pri visokih temperaturah ali s stikom z virom vžiga.
- Fini prah, ki se razprši v zraku, v zadostnih koncentracijah in v prisotnosti vira vžiga, je potencial nevarne eksplozije prahu.
- Je stabilna snov pri sobni temperaturi in v ustreznih pogojih skladiščenja. Izogibati se je treba prekomerni toploti in vlagi.
- Lahko ni združljiv z močnimi oksidanti, kot je dušikova kislina.
- Razgradnjo lahko tvori ogljikove okside, ki so strupeni.
Glede zdravja
- Z naključnim zaužitjem lahko povzroči bruhanje, drisko in draženje v membranah zaradi njihove kislosti.
- Z vdihavanjem povzroči draženje v dihalnih poteh in kašlju.
- V koži povzroča draženje.
- V očeh povzroča draženje, rdečico in bolečino.
- Šteje se, da ne gre za rakotvorno, teratogeno ali mutageno snov.
Nujna in prva pomoč
- Oči operete z veliko vode, odstranite upočasnitve, če jih nosite in pustite, da voda teče skozi oči, ne da bi se dotaknili z rokami.
- Če je bil stik s kožo, odstranite kostume in obutev, operite z veliko vode in zelo dobro operite, preden ponovno uporabite.
- V primeru zaužitja se izogibajte bruhanju, pitni vodi.
- V primeru vdihavanja vzemite osebo, da vdihne svež zrak; V primeru težkega diha oskrbovanje kisika.
- V vseh primerih zahtevajte nujno zdravniško pomoč.
- V primeru puščanja ali razlitja izdelka zberite v čisti posodi in poskusite, da se prah ne razprši.
Lahko vam služi: kakšni so negativni učinki, ki jih imamo z topnostjo vode?Ukrepi za osebno zaščito
- Izogibajte se kraju, kjer so shranjene pijače, hrana in krma (hrana za hišne ljubljenčke).
- Uporabite maske proti prahu, neoprenske ali PVC rokavice. Trenutno se uporabljajo nitrile rokavice.
- Nosite ustrezna oblačila, ki pokrivajo večino telesa, vključno s pokritimi škornji ali čevlji in varnostnimi očali.
- Priporočljivo je lokalno prezračevanje izpušnih plinov s sistemom za ekstrakcijo zraka, ob upoštevanju prevladujoče smernice vetra.
- Izdelek je mešan v vodi, se ne absorbira na tleh, ni bioakumulabilen ali biološko razgradljiv, ne pričakuje se, da bo vplival na vodno življenje. Vendar pa ga je treba v času zavrnitve s pomočjo specializiranega osebja: ne zavrzite z odtoki.
- Shranite v oranžno/zeleno površino, sveže suho in prezračeno mesto ter ločeno od nezdružljivega materiala.
Reference
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), Kemija, (četrta izdaja), Mehika, McGraw-Hill Interamerican iz Mehike S.A, iz c.V
- Meyer kemijski reagenti, (-i.f), varnostni podatkovni list, kalijev biftalat, obnovljen iz, ReagentsMeyer.com.mx
- Belcher, r.,Erdey, l.,Paulik, f.,Liptay.G.,(Julij 1960), ogenj kalijevega hidrogenoftalatalata, Znanstveno, 5. zvezek, številka 1, Strani 53-57, org/10.1016/0039-9140 (60) 80205-6

