Bromotimol Blue

- 4839
- 1168
- Dexter Koch
 Bromotimol Blue je pH indikator. Vir: Wikimedia Commons
Bromotimol Blue je pH indikator. Vir: Wikimedia Commons Kaj je bromotimol modro?
On Bromotimol Blue Je derivat trifenilmetana, ki služi kot indikator pH. Indikator je organsko barvilo, katerega barva je odvisna od koncentracije iona H3Tudi+ ali srednjega pH. Zaradi barve, ki jo ima, lahko indikator označi kislost ali alkalnost raztopine.
Bromotimol Blue ima aktivno indikalno lestvico med pH 6.0 in 7.6. Do pH medija, manjšim od 6.5 (kislina) manifestira rumeno obarvanost. Ko se srednji pH giblje med 6.5 in 7.6 (nevtralno), pridobi zeleno obarvanost. PH večji od 7.6 Njegova barva je modra (osnovna).
Ta funkcija ji daje veliko koristnost, saj jo je mogoče uporabiti na pH lestvici, ki je blizu nevtralnosti, natančno tam, kjer se pojavljajo fiziološki procesi.
Bromotimol modra ionizacija v vodni raztopini je mogoče shematizirati na naslednji način:
Hin (rumena) +h₂o v- (modra barva) + h3Tudi+
Ko je indikator protoniran (HIN), pridobi rumeno obarvanost; Medtem ko je indikator nezaščiteni (v-) Barvanje je modro.
Kemična struktura
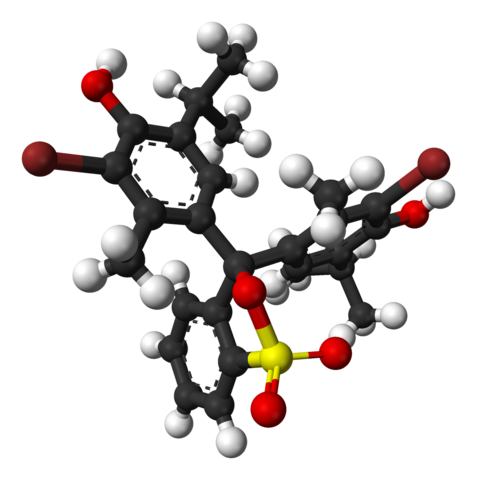 Kemična struktura bromotimol modre barve. Vir: Wikimedia Commons
Kemična struktura bromotimol modre barve. Vir: Wikimedia Commons Na zgornji sliki je struktura Bromotimol Blue predstavljena z modelom palice in kroglami do pH manj kot 7.1. Rjave palice ustrezajo atomom broma, skupaj dva.
Vsak od treh aromatičnih obročev je sestavljen poleg metilnih skupin, CH3, In termalna, timolska skupina in ko je povezala BR, od tam se razlog imenuje "Bromotimol".
Vam lahko služi: hidroksidiV spodnjem delu je prikazana skupina sulfonata, r-So3-, Z rdečimi sferami in rumeno. To skupino je mogoče povezati z atomom ali osrednjim ogljikom, ki se pridruži trem aromatičnim obročem.
PH spremembe
Ta molekularna struktura, čeprav se ne spreminja korenito s kislim ali osnovnim pH.
Pod pH 7 je indikator rumen in sprejme strukturo slike, če pa pH postane osnovni, so skupine -OH nesrečne in lahko tvorimo dvojno vez C = O.
Kot rezultat, se konjugirani sistem molekule (od vseh njegovih dvojnih resonančnih vezi) spreminja dovolj, da elektroni ne absorbirajo več istih fotonov, raztopina pa postane od rumene do modrike.
Če je na drugi strani pH precej pod 7, se barva indikatorja spremeni iz rumene v rdečo. Tu je sprememba konjugiranega sistema posledica protonacije skupin -OH A -OH2+. -
Tako v kislem kot v osnovnem mediju molekula izgubi stabilnost in absorbira manjše fotone, ki omogočajo elektronske prehode, odgovorne za barve, ki jih zaznavajo gledalci.
Zelena barva, opažena na glavni sliki, je posledica naslednjega: ko pH pri 7 približa.1, majhen del molekul izgubi protone in se poslovi od modre barve, ki z mešanjem z rumeno daje zeleno barvo.
Lastnosti dBROMOOTIMOL BLUE
Kemijsko ime
Bromotimol modra ali 3.3'-dibromotimolsulfonafet.
Molekularna formula
C27H28Br2Tudi5S.
Molekularna teža
624.384 g/mol.
Fizični videz
Trden barvni prah, ki sega med roza in vijolično.
Vam lahko služi: butanal: struktura, lastnosti, uporabe in tveganjaKemična značilnost
Deluje kot šibka kislina v raztopini. Ko je protoniran v kislem mediju, pridobi rumeno barvo, nevtralni pH je zelen in ko je v alkalnem pH neprijeten, je modra.
Ionska disociacijska konstanta (Ka)
7.9 x 10-8.
Aktivno območje indikacij
ph 6.0 do 7.6. To je posledica prisotnosti atomov broma, ki delujejo z ekstrahiranjem elektronov, in dveh zmernih skupin darovalcev elektronov (alkilni substituenti).
Gostota
1.25 g/cm3.
Tališče
202 ° C (396 ° F).
Vrelišče
184.9 ° C.
Topnost
V vodi in olju je komaj topno. Prav tako je malo topna v ne -polarnih topilih, kot so benzen, toluen in ksilen, in praktično netopna v oljnem etru. Topno je v vodnih raztopinah alkalij in alkohola.
Stabilnost
Je stabilen pri temperaturi okolice in nezdružljiv z močnimi oksidacijskimi sredstvi.
Absorpcija svetlobe
Protonirana oblika ima največjo absorpcijo pri valovni dolžini (λ) 427 nm, s čimer prenaša rumeno svetlobo v kislih raztopinah, nezaščitena oblika Alkalni pH.
Uporaba in aplikacije
V presnovnih študijah
Bromotimol Blue se uporablja v številnih procesih, v katerih nastane ogljikov dioksid (CO₂), s posledično nastajanje ogljikove kisline (H2Co3), ki zakimava medij, kar dokazuje sprememba barvanja bromotimol modre barve.
Če človek izvaja telesno vajo in je povezan s cevjo, ki je posledično povezana s posodo z raztopino bromotimol modre Presnova, prišlo bo do povečanja proizvodnje Co₂.
Vam lahko služi: silicij: zgodovina, lastnosti, struktura, pridobivanje, uporabeCo₂ bo reagiral z vodo in proizvajal ogljikovo kislino, h2Co3, da kasneje disociira sproščanje iona h+ in zakisanje medija. Posledica tega je, da Bromotimol Blue pridobi rumeno obarvanost, ki poudarja kislost okolja.
V porodništvu
Bromotimol Blue se uporablja v porodništvu za prikaz zgodnjega razpada membran. Amnijska tekočina ima običajno pH večji od 7.7, tako bo Bromotimol Blue obarval modro, ko stopi v stik s tekočino, ki pobegne.
Vaginalni pH je ponavadi kisel, zato ima bromotimol modra obarvanost. Sprememba njegove barve v modro kaže prisotnost amnijske tekočine v vaginalnem območju.
Druge uporabe
Bromotimol Blue ima tudi uporabo v naslednji opremi in funkcijah:
- Optični senzorji
- Sistemi za odkrivanje izgorevanja plina
- V izdelavi slik, igrač, čistilnih izdelkov, detergentov in tekstila
- Senzorji svežine hrane
- Kot svež identifikator riža in rancid
- Pri odkrivanju mikroorganizmov.
Uporablja se tudi pri analizi rasti bakterij, psihoaktivnih zdravilih in zobnih materialih.
Priprava
100 mg bromotimol modre barve se raztopi v 100 ml razredčenega alkohola in po potrebi filtrira. Pripravljen je tudi na naslednji način: 50 mg bromotimolske modre barve se raztopi v mešanici 4 ml 0,02 N natrijevega hidroksida in 20 ml alkohola, dopolnjuje 100 ml z vodo z vodo.
Reference
- Foist l. Bromothymol Blue: definicija, uporabe in formula. Študija je bila obnovljena.com
- Indikator pH Bromothymol Blue, 1 oz. Okreval po ScienceCompany.com
- Spektrofotometrična določitev PK indikatorja bromotimola modrega. Okreval od FCH.UPOL.cz

