Zgodovina žvepla, lastnosti, struktura, pridobivanje, uporabe

- 5014
- 1524
- Lee Farrell
On žveplo To je nemetalni element, ki vodi pod kisikom, skupino kalkogenov v periodični tabeli. Nahaja se posebej v skupini 16 z obdobjem 3 in je predstavljen s kemičnim simbolom S. Njegovih naravnih izotopov, 32S veliko spi (približno 94% vseh atomov žvepla).
Je eden najpogostejših elementov na Zemlji, ki sestavlja približno 3% celotne mase. To pomeni, da bi lahko zgradili dve rumeni luni, če bi vzeli ves žveplo planeta; Namesto enega bi bili trije sateliti. Sprejema lahko več oksidacijskih stanj (+2, -2, +4 in +6), tako da so njihove soli številne in obogatijo kopensko skorjo in jedro.
 Kristali žvepla. Vir: Pixabay.
Kristali žvepla. Vir: Pixabay. Žveplo je sinonim za rumene, slabe vonjave in pekel. Glavni razlog za svoje slabe vonjave je posledica izpeljanih spojin; še posebej plinasti in organski. Od ostalih so njihovi minerali trdni in imajo barve, ki vključujejo rumeno, sivo, črno in belo (med drugim).
To je eden od elementov, ki večina predstavlja široko število alotropov. Najdemo ga kot majhne in diskretne molekule S2 ali s3; Kot obročki ali cikli, ki so ortorrambični in monoklinski žveplo s8 najbolj stabilen in obilen od vseh; In kot spiralne verige.
Ne samo, da ga najdemo v kopenski skorji v obliki mineralov, ampak tudi v bioloških matricah naših teles. Na primer, to je v cistinu, cisteinu in metioninskih aminokislinah, v beljakovinah železa, keratina in vitaminov. Prisoten je tudi v česnu, grenivnikih, čebuli, zelju, brokoliju in cvetaču.
Kemično gre za mehak element in v odsotnosti kisika v obliki žveplovih mineralov in sulfatov. Opekline z modrikastim plamenom in se lahko prikažejo kot amorfna ali kristalna trdna.
Kljub temu, da je nepogrešljiv za sintezo žveplove kisline, zelo korozivne snovi in dodelitev neprijetnih vonjav, je to pravzaprav benigni element. Žveplo je mogoče shraniti v katerem koli prostoru brez večjih previdnostnih ukrepov, dokler se požari izogibajo.
[TOC]
Zgodovina žvepla
V Bibliji
Sulfur je eden najstarejših elementov v zgodovini človeštva; Toliko, da je njegovo odkritje negotovo in ni znano, katera od starodavnih civilizacij so jo uporabljali prvič (4000 let pred Kristusom). Na istih straneh Biblije lahko najdete infernalni ogenj in razpade.
Verjame se, da je domnevni vonj pekla povezan z vulkanskimi izbruhi. Njegov prvi odkrivalec je zagotovo naletel na rudnike tega elementa kot prah ali rumene kristale v bližini vulkana.
Antika
Ta rumenkasto trdno snov je kmalu pokazala opazne zdravilne učinke. Egipčani so na primer uporabili žveplo za zdravljenje vnetja vek. Prav tako je razbremenila scabi in akne, aplikacijo, ki jo je danes mogoče videti v žveplovih milih in drugih dermatoloških predmeti.
Rimljani so ta element uporabili v svojih obredih, kot sta fumigante in beljenje. Ko knjižnico SOS2, plin, ki je preplavil prostore, ki se mešajo z vlago in zagotavljajo antibakterijski medij in je sposoben uničiti žuželke.
Rimljani so, tako kot Grki, odkrili visoko vnetljivost žvepla, zato je postal sinonim za ogenj. Barva njegovih modrikastih plamenov je morala osvetliti rimske cirkuse. Verjame se, da so Grki medtem uporabili ta element za ustvarjanje zažigalnega orožja.
Kitajci na njihovi strani so izvedeli, da mešanje žvepla s solnico (kno3) in premog je ustvaril črnega smodnika, ki je plačal zgodovinski promet, in ki je vzbudil v narodih takratnih velikih zahtev in zanimanja za ta mineral.
Lahko vam služi: Cirkonium: Zgodovina, lastnosti, struktura, tveganja, uporabeSodobni čas
Kot da Gurnilnik ni bil zadosten razlog za hrepenenje po žveplom, se je kmalu pojavila žveplova kislina in industrijska uporaba. In s palico z žveplovo kislino je bila izmerjena količina bogastva ali blaginje države glede na stopnjo porabe te spojine.
Šele leta 1789, ko je briljantni kemik Antoine Lavoisier lahko prepoznal žveplo in ga razvrstil kot element. Nato je leta 1823 nemški kemik Eilhard Mitscherlich odkril, da lahko žveplo pretežno kristalizira na dva načina: Rhomboédrica in Monoklinic.
Zgodovina žvepla je sledila istemu kanalu njegovih spojin in aplikacij. Z ogromnim industrijskim pomenom žveplove kisline je spremljal vulkanizacijo gume, sintezo penicilina, izkoriščanje rudarjenja, rafiniranje oljnih surovin, ki so bolj z žveplom, prehrano tal itd.
Lastnosti
Fizični videz
Vetrič trden v prahu ali kristalih. Njegova barva je neprozorna limono rumena, je brez okusa in manjka vonja.
Tekoči videz
Tekoči žveplo je edinstveno, ker njegova začetna rumena barva postane rdečkasta in se okrepi in zatemni, če se podvrže visokim temperaturam. Ko gori, recimo modri in svetli plameni.
Molarna masa
32 g/mol.
Tališče
115.21 ° C.
Vrelišče
445 ° C.
točka vžiga
160 ° C.
Temperatura samoificiranja
232 ° C.
Gostota
2.1 g/ml. Vendar so lahko drugi alotropi manj goste.
Molarna toplotna sposobnost
22,75 j/mol · k
Radijski kovalent
105 ± 3 pm.
Elektronegativnost
2.58 na lestvici Pauling.
Polarnost
Povezave S-S so apolarne, ker imata oba žveplova atoma enako elektronegativnost. Zaradi tega so vsi alotropi, ciklični ali v obliki verig, apolarno; In zato so njene interakcije z vodo neučinkovite in jih ni mogoče solubilizirati.
Vendar pa lahko žveplo raztopimo v apolarnih topilih, kot je ogljikov disulfid, CS2, in aromatični (benzen, toluen, ksilen itd.).
Ioni
Žveplo lahko tvori več ionov, na splošno anionov. Najbolj znan od vsega je sulfid, s2-. S2- Zanj je značilna zajetna in mehka podlaga Lewisa.
Ker je mehka osnova, teorija ugotovi, da bo ponavadi tvorila spojine z mehkimi kislinami; Kot kationi tranzicijske kovine, vključno z vero2+, Pb2+ in cu2+.
Elektronska struktura in konfiguracija
Krona žvepla
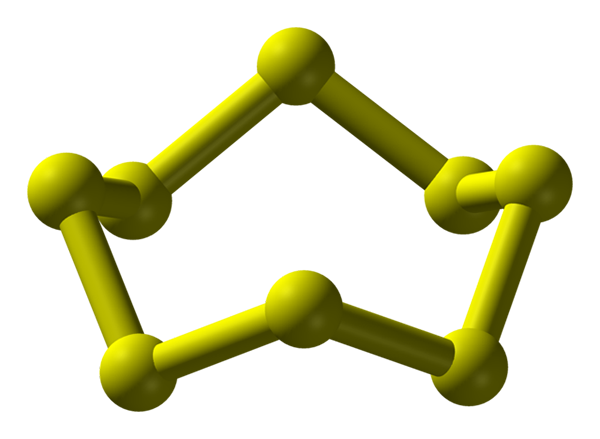 S8 molekula, najbolj stabilna in obilna alotropna žvepla. Vir: Benjah-BMM27.
S8 molekula, najbolj stabilna in obilna alotropna žvepla. Vir: Benjah-BMM27. Žveplo se lahko pojavi v najrazličnejših alotropih; in te imajo kristalne strukture, ki so spremenjene pod različnimi pritiski in/ali temperaturo. Zato je žveplo bogat element v alotroposu in polimorfih, preučevanje njegovih trdnih struktur pa predstavlja neskončen vir teoretično-eksperimentalnih del.
Zakaj takšna strukturna zapletenost? Za začetek so kovalentne vezi v žveplom (S-S) zelo močne, saj jih premagajo le ogljik, C-C in vodik, H-H.
Žveplo, za razliko od ogljika, ne tvori tetraedre, ampak boomerangov; da se s svojimi koti zložijo in zvonijo, da stabilizirajo žveplove verige. Najbolj znan prstan vseh, ki predstavlja tudi najbolj stabilno alotropno žveplo, je S8, "Krona žvepla" (višja slika).
Upoštevajte, da vse povezave S-S8 Se zdijo individualni boomerangi, kar ima za posledico prstan z gubami in ravnim. Te krone s8 Sodelujejo prek londonskih sil, usmerjenih tako, da jim uspe ustvariti strukturne vzorce, ki definirajo ortorrombični kristal; imenovan s8 α (s-α ali preprosto ortorrambično žveplo).
Vam lahko služi: elastični materialiPolimorfi
Krona žvepla je ena izmed številnih alotropov za ta element. S8 α je polimorf te krone. Obstajata še dva (med najpomembnejšimi)8 β in s8 γ (S-β in S-γ). Oba polimorfa kristalizirata v monoklinskih strukturah, ki sta S8 γ je gostejši (žveplo gama).
Tri so rumene trdne snovi. Kako pa se vsak polimorf pridobi ločeno?
S8 β pripravlja S8 α pri 93 ° C, nato pa omogoči njegovo počasno hlajenje, da upočasni povratni prehod v ortrorombično fazo (α). In s8 γ na drugi strani dobimo, ko temelji8 α pri 150 ° C, kar omogoča, da se spet počasi ohladi; Je najgostejši polimorfi krone žveplove krone.
Drugi ciklični alotropi
Krona s8 Ni edini ciklični alotrop. Obstajajo drugi, kot je S4, S5 (Analog za ciklopentano), S6 (zastopano s šesterokotnikom in ciklom), S7, S9, in s10-20; Slednje pomeni, da lahko obstajajo obroči ali cikli, ki vsebujejo od deset do dvajset žveplovih atomov.
Vsak od njih predstavlja različne žveplove ciklične alotrohine; In da bi ga poudarili, imajo različice polimorfov ali polimorfnih struktur, ki so odvisne od tlaka in temperature.
Na primer S7 Ima do štiri znane polimorfe: α, β, γ in δ. Člani ali krone večjih molekulskih mas so organski sintezni produkti in ne prevladujejo v naravi.
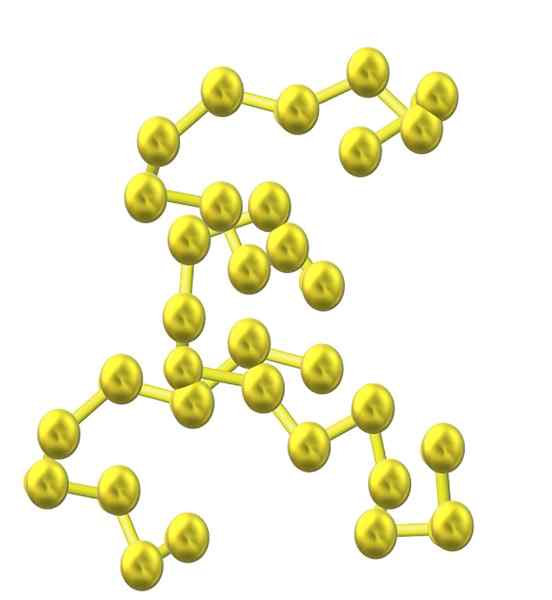
Žveplove verige
 Žveplova veriga. Vir: Opentax [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)]
Žveplova veriga. Vir: Opentax [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)] Ker je v strukturo vključenih več atomov žvepla, se njihova nagnjenost k zvonjenju zmanjšuje, žveplove verige.
In tako nastane še ena obsežna družina žveplovih alotrop.
Ko se te verige S-S poravnajo vzporedno s kozarcem, ujamejo nečistoče in na koncu definirajo vlaknasto trdno snov, imenovano vlaknasti žveplo, ali s-ψ. Če med temi vzporednimi verigami obstajajo kovalentne vezi, ki jih povezujejo (kot pri vulkanizaciji gume), imamo laminarno žveplo.
Ko žveplo s8 Topi rumenkasto tekoča faza, ki lahko postane temna, če se temperatura poviša. To je zato, ker so povezave S-S porušene in se zato pojavlja postopek toplotne depolimerizacije.
Ta tekočina, ko se ohladi, prikazuje plastične lastnosti in nato steklene; to pomeni, da dobimo steklasti žveplo in amorfno (s-were). Njegova sestava je sestavljena iz obročev in žveplovih verig.
In ko mešanico vlaknaste in laminarne alotrope dobimo iz amorfnega žvepla, komercialnega izdelka, ki se uporablja za vulkanizacijo gume.
Majhni alotropi
Čeprav so ostali zadnji, niso manj pomembni (ali zanimivi) kot alotropos največjih molekulskih mas. S2 in s3 so sulfurizirane različice O2 jaz3. V prvih dveh atomih žvepla se združijo z dvojno vezjo, s = s, v drugem pa tri atome z resonančnimi strukturami, S = S-S.
Oba s2 kot s3 So plinasti. S3 Manifestiraj češnjevo rdečo obarvanost. Oba imata dovolj bibliografskega materiala za posamezen članek.
Elektronska konfiguracija
Elektronska konfiguracija za atom žvepla je:
[NE] 3S2 3P4
Za dokončanje okteta iz Valencije si lahko zaslužite dva elektrona in tako imate oksidacijsko stanje -2. Prav tako lahko izgubite elektrone, začenši z dvema v njegovih 3P orbitalih, kar je njegovo oksidacijsko stanje +2; Če izgubite še dva elektrona, s praznimi 3P orbitali, bo vaš status oksidacije +4; In če izgubite vse elektrone, bo to +6.
Vam lahko služi: metaloidiPridobivanje, kje je žveplo?
Mineraloški
Žveplo je del številnih mineralov. Med njimi je pirit (FES2), La Galena (PBS), Covellita (CUS) in drugi minerali sulfata in sulfidov. Z njihovo obdelavo ni mogoče izvleči samo kovin, ampak tudi žveplo po nizu reduktivnih reakcij.
Dobimo ga lahko tudi izključno v vulkanskih odprtinah, kjer se temperatura dvigne in razlije navzdol; In če bo zažgal, bo videti kot modrikasta lava. Z napornim delom in napornimi fizičnimi deli lahko zbiramo žveplo, saj je bilo to storjeno na Siciliji precej pogosto.
Žveplo je mogoče najti tudi v podzemnih rudnikih, ki so narejene za črpanje pregrevanja vode, da se tali in prenese na površino. Ta postopek pridobivanja je znan kot Brasch postopek, trenutno malo uporabljen.
Nafta
Danes večina žvepla prihaja iz naftne industrije, saj so njegove organske spojine del sestave naftne nafte in njegovih rafiniranih derivatov.
Če je rafinirana surova ali izdelek bogata z žveplom in se podvrže hidrodesulfurizaciji, bo sprostila velike količine H2S (smrdljiv plin, ki diši po gnilo jajci):
R-s-r + 2 h2 → 2 rh + h2S
Potem h2S Kemično je v postopku Claussa, povzeto z naslednjimi kemičnimi enačbami:
3 o2 + 2 h2S → 2 Torej2 + 2 h2Tudi
SW2 + 2 h2S → 3 s + 2 h2Tudi
Prijave
Nekatere uporabe žvepla so omenjene spodaj in na splošno:
- Je bistveni element tako za rastline kot za živali. Prisotna je celo v dveh aminokislinah: cistein in metodin.
- Je surovina za žveplovo kislino, sestavljena pri pripravi neštetih komercialnih izdelkov.
- V farmacevtski industriji je namenjen sintezi žveplovih derivatov, penicilin pa je najbolj znan od primerov.
- Omogoča vulkanizacijo gub z medsebojno povezovanje polimernih verig s povezavami S-S.
- Njegova rumena barva in mešanice z drugimi kovinami so v pigmentni industriji zaželene.
- Mešano z anorgansko matrico, kot so pesek in kamnine, beton in žveplov asfalt, je pripravljen za zamenjavo bitumena.
Tveganja in previdnostni ukrepi
Žveplo je samostojno neškodljivo, netoksično snov in predstavlja tudi potencialna tveganja, razen če reagira na druge spojine. Njegove sulfatne soli niso nevarne in jih je mogoče manipulirati brez večjih varnostnih ukrepov. Vendar se to ne zgodi s svojimi plinastimi derivati: Torej2 in h2S, oba izjemno strupena.
Če je v tekoči fazi, lahko povzroči resne opekline. Če zajema v velikih količinah, se lahko sproži2S v črevesju. Za ostalo ne predstavlja tveganja za tiste, ki žvečijo.
Na splošno je žveplo zanesljiv element, ki ne potrebuje preveč previdnostnih ukrepov, razen če ga ne držimo pred ognjem in močnimi oksidacijskimi sredstvi.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Laura Crapanzano. (2006). Polimorfizem žvepla: strukturni in dinamični vidiki. Fizika [fizika].University Joseph -fourier - Grenoble i. angleščina. FFTEL-00204149F
- Wikipedija. (2019). Alotropi žvepla. Pridobljeno iz: v.Wikipedija.org
- Meyer Beat. (1976). Elementarni žveplo. Chemical Reviews, Vol. 76, ne. 3.
- Doktor. Doug Stewart. (2019). Dejstva o žveplovih elementih. Kemikool. Okrevano od: Chemicool.com
- Donald w. Davis in Randall a. Detro. (2015). Zgodovina žvepla. Korporacija Gulf Gulf Gulf Sulfur. Okrevano od: Georgiagulfsulfur.com
- Čelada, Anne Marie, ph.D. (11. januar 2019). 10 zanimivih dejstev žvepla. Okreval od: Thoughtco.com
- Boone, c.; Obveznica, c.; Hallman, a.; Jenkins, j. (2017). Splošni list dejstev za žveplo; Nacionalni informacijski center za pesticide, storitve razširitve na univerzi Oregon State University. NPIC.Orst.Edu

