Značilnosti asparagina, struktura, funkcije, biosinteza
- 1660
- 434
- Don Nitzsche
The Asparagina (ASN ali N) je pomembna aminokislina za celično signalizacijo in združitev med beljakovinami in ogljikovimi hidrati. To je ena od 22 osnovnih aminokislin in je katalogizirana kot nesebna, saj ga sintetizira telo sesalcev.
Ta aminokislina je razvrščena v skupino polarnih aminokislin brez obremenitve in je bila prva gola aminokislina, dejstvo, ki se je zgodilo leta 1806, kjer so jo francoski kemični vauquelin in Robiquet.
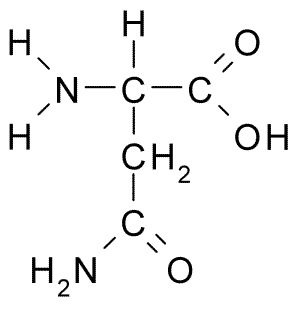
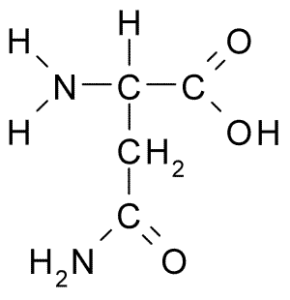 Kemična struktura aminokislinskega asparagina (vir: BORB, prek Wikimedia Commons)
Kemična struktura aminokislinskega asparagina (vir: BORB, prek Wikimedia Commons) Kljub zgodnjemu odkritju biološke in prehranske vloge asparagina ni bila prepoznana, vendar več kot 100 let pozneje, ko je bila leta 1932 potrjena njena prisotnost v strukturi beljakovin, ki je prisotna v semenu konoplje.
Asparagin in glutamin služita kot substrati za amid skupin dveh zelo pogostih aminokislin v beljakovinah: asparagic (asparaginska kislina) in glutamata (glutaminska kislina). Asparagin in glutamin v teh aminokislinah zlahka hidroliziramo z encimskim delovanjem ali kislino in osnovnimi spojinami.
Številni encimi serinske proteaze, ki so odgovorni za hidroliziranje peptidnih vezi, imajo asparagin v stranski verigi njihovega aktivnega mesta. Ta ostanek ima negativno delno obremenitev in je odgovoren za komplementarno povezavo s pozitivno obremenitvijo belih peptidov, pri čemer se približuje mestu rezanja.
Encim, zadolžen za sintezo oksalacetata iz asparagina.
Asparaginaza je preveč izražena in očiščena Escherichia coli, Vbrizgati se pri otroških bolnikih, ki imajo akutno limfoblastično levkemijo, saj so normalni in maligni limfociti odvisni od zajetja asparagina v krvi za rast in množenje.
[TOC]
Značilnosti in struktura
Vse kemijske strukture aminokislin imajo karboksilno skupino (-HOH), amino skupino (-NH3+), vodik (-H) in R ali substituent skupine, ki jih združuje isti centralni atom ogljika, znan kot ogljik α.
Aminokisline se med seboj razlikujejo po identiteti svojih stranskih verig, ki so tiste, ki so znane kot R skupine in se lahko razlikujejo po velikosti, strukturi, funkcionalnih skupinah in celo električnem naboju.
Ogljikovi atomi R skupinah se identificirajo s črkami iz grške abecede. Tako so v primeru asparagina ogljikove verige identificirani kot β in γ ogljiki.
Vam lahko služi: agar xld: fundacija, priprava in uporabeGlede na drugo vrsto nomenklatur je ogljikov atom v karboksilni skupini (-HOH) naveden kot C-1, tako da bi bil karbon α nadaljeval s oštevilčenjem.
Molekula asparagina ima štiri ogljikove atome, vključno z ogljikovim α, karbonskim ogljikom karboksilnim skupinam in dvema atomima ogljika, ki sta del skupine R, znan kot karboksamid (-CH2-Co-Co-NH2).
To skupino karboksamida najdemo le v dveh aminokislinah: v asparaginu in glutaminu. Ima značilnost, da lahko z veliko lahkoto tvori vodikove mostove skozi amino skupino (-NH2) in karbonilno skupino (-CO).
Klasifikacija
Asparagin spada v skupino polarnih aminokislin brez obremenitve, ki so zelo topne aminokisline v vodi in zelo hidrofilne (zaradi njihove tvorbe večkratnih mostov).
V skupini polarnih aminokislin brez obremenitve so tudi serin, treonin, cistein in glutamin. Vse to so spojine "Zwitterionics"Ker imajo v svoji R verigi polarno skupino, ki prispeva z nevtralizacijo obremenitev.
Vse polarne aminokisline brez obremenitve niso ionizirane pri pH blizu 7 (nevtralnega), to je, da nimajo pozitivnih ali negativnih nabojev. Vendar so v kislih in osnovnih medijih substituenti ionizirani in pridobijo breme.
Stereokemija
Osrednji ogljik ali α ogljik aminokislin je kiralni ogljik, nato pa ima štiri različna združena substituenta, kar povzroči vsaj dva različna stereoizomera za vsako aminokislino.
Stereoizomeri so spekularne podobe molekule, ki imajo enako molekularno formulo, vendar jih med seboj ne morejo vesti, kot so roke (levo in desno). Označeni so s črko D ali L, saj eksperimentalno raztopine teh aminokislin zasukajo polarizirano svetlobno ravnino v nasprotnih smereh.
Splošna asimetrija aminokislin naredi stereokemijo teh spojin velikega pomena, saj ima vsaka različne lastnosti, je sintetizirana in sodeluje na različnih presnovnih poteh.
Asparagin je mogoče najti v obliki D-asparagina ali L-asparagina, pri čemer je slednji najpogostejši po naravi. Sintetizira ga L-sintezaza in presnova za L-asparaginazo, oba encima sta zelo obilna v jetrih vretenčarjev.
Funkcije
Enostavnost tvorjenja asparagin vodikovega mostov je ključna aminokislina za strukturno stabilnost beljakovin, saj lahko tvori notranje vodikove mostove s stranskimi verigami drugih aminokislin, ki jih sestavljajo.
Vam lahko služi: 25 primerov aseksualne reprodukcijeAsparagin običajno najdemo na površini tipičnih vodnih medijev, ki stabilizira njihovo strukturo.
Številni glikoproteini se lahko vežejo na ogljikove hidrate ali ogljikove hidrate prek ostankov asparagina, treonina ali serina. V primeru asparagina se acetil galaktozamin na splošno pridruži amino skupini z N-glicikozilacijo.
Pomembno je poudariti, da se v vseh N-glikoziliranih glikoproteinih ogljikovih hidratov na to vežejo z ostankom asparagina, ki je v določenem območju, označenem kot ASN-X-SER/THR, kjer je x katera koli aminokislina.
Ti glikoproteini so sestavljeni v endoplazemskem retikulumu, kjer so glikozilirani, ko so prevedeni.
Biosinteza
Vsi evkariontski organizmi asimilirajo amonijak in ga preoblikujejo v glutamat, glutamin, karbamil-fosfat in asparagin. Asparagin je mogoče sintetizirati iz glikolitičnih posrednikov, v ciklu citronske kisline (iz oksalacetata) ali iz predhodnikov, porabljenih v prehrani.
Encim asparagina s sintetazo je amidotransferaza, ki je odvisna od glutamina in ATP, da ATP in anorganski pirofosfat (PPI) pljuva in uporablja amoniak ali glutamin za katalizacijo reakcije amidacije in pretvorbe aspartata v aparagin v aparagin.
Tako bakterije kot živali imajo asparagin s sintetizo, vendar v bakterijah encim uporablja amonijev ion kot dušikovni darovalec, pri sesalcih.
Encimska ruptura ATP na AMP in anorganski pirofosfat (PPI), skupaj z glutaminom kot darovalcem skupine Amida, so glavne razlike glede biosinteze L-glutamina med različnimi organizmi.
Degradacija
Večina raziskav o presnovi asparagina je bila izvedena v rastlinah, glede na to, da so prvotno študije pri sesalcih ovirale pomanjkanje metodologij, ki so dovolj občutljive za aminokislinske teste na ravni bolj zapletenih sistemov.
L-asparagin nenehno hidrolizira pri sesalcih z L-asparaginazo, da povzroči asparaginsko kislino in amonij. Uporablja se za sintezo glikoproteinov in je eden glavnih predhodnikov oksalacetata za cikel citronske kisline.
Encim asparaginaze katalizira hidrolizo asparagina v aspartat, nato pa aspartat prežene z α-cetoglutaratom, da nastane glutamat in oksalacetat.
Vam lahko služi: epiblastSyntheta asparagin, znan tudi kot aspartat-amoniaco ligaza, najdemo obilno iz možganskih celic sesalcev.
Ko se v telesu zaznajo nizke ravni tega encima, se tvori tisto, kar je znano kot "aminoacidopatije", saj se v citoplazmi možganskih celic kopičijo predhodniki.
Živila, bogata s asparagino
Ljudje, ki imajo akutno limfoblastično levkemijo, imajo ponavadi pomanjkljivosti glede encima asparagina s sintetizo in so odvisni od asparagina v obtoku, zato jih priporočamo dieta v živili.
Med več živil z visoko vsebnostjo asparagina je ona.
Obstajajo koncentrati L-asparagina, ki so oblikovani za športnike z visoko konkurenco, saj njihova poraba pomaga regenerirati beljakovine, ki sestavljajo tkiva.
Poleg tega ljudje, ki imajo primanjkljaj v sintezi aminokislin, zaužijejo tudi te tablete, da se izognejo motnjam v svojem osrednjem živčnem sistemu.
Asparagin je lažje presnavljati s svojo obliko L-asparagin, saj mnogi encimi, ki sodelujejo pri njihovi presnovi.
Obiten vnos asparagina je lahko koristen, vendar se priporoča.
Reference
- Cooney, d. Do., Capizzi, r. L., & HandsChumacher, r. In. (1970). Vrednotenje metabolizma L-asparagina v Animasu in človeku. Raziskave raka, 30 (4), 929-935
- Dunlop, str. C., Roon, r. J., & Celo, h. L. (1976). Uporaba D-asparagina s strani Saccharomyces cerevisiae. Časopis za bakteriologijo, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Napredek pri presnovi asparagina. V Napredek v botaniki Vol. 79 (str. 49-74). Springer, Cham.
- KORNFELD, R., & Kornfeld, s. (1985). Montaža oligosaharidov, povezanih z asparaginom. Letni pregled biokemije, 54 (1), 631–664
- Mathews, c. K., & Ahern, k. G. (2002). Biokemija. Pearson Education.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-asparagin. Kristalografsko dejanje Oddelek E: Poročila o strukturi na spletu, 63 (9), 3802-3803.

