Zgodovina arzena, struktura, lastnosti, uporabe

- 3524
- 835
- Ms. Pablo Lebsack
On arzen To je polmetalni ali metaloid, ki spada v skupino 15 ali gre iz periodične tabele. Predstavljen je s kemičnim simbolom kot in ima atomsko številko 33. Lahko je manj kot tri alotropne oblike: rumena, črna in siva; Slednji je edini z industrijskim pomenom.
Siva arzen je kovinska, krhka trdna s trdno in kristalno barvo (spodnja slika). Izgubi svetlost, ko je izpostavljen zraku, ki tvori arsenioso oksid (kot2Tudi3), ki ob segrevanju oddaja vonj česna. Po drugi strani so njeni rumeni in črni alotrohos molekularni oziroma amorfni.
 Kovinski arzen. Vir: Hi-res slike kemičnih elementov [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]
Kovinski arzen. Vir: Hi-res slike kemičnih elementov [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] Arzen se nahaja v zemeljski skorji, povezani s številnimi minerali. Le majhen delež je v domači državi, vendar je povezan z antimonom in srebrom.
Med najpogostejšimi minerali, v katerih je arzen, so: Rejalgar (kot4S4), Oropiment (kot2S3), Loellingta (grda2) in Enargita (Cu3Rit4). Arzen je pridobljen tudi kot kolateralni produkt livarne kovin, kot so svinec, baker, kobalt in zlato.
Arzenske spojine so strupene, zlasti Arsina (Ash3). Vendar pa ima Arsenic številne industrijske aplikacije, vključno z zlitino s svincem, ki se uporablja pri izdelavi avtomobilskih baterij, in zlitino z Gallium z več uporabi v elektroniki.
[TOC]
Zgodovina vašega odkritja
Ime "arzena" izvira iz latinskega arsenicuma in grškega arsenika, ki se nanaša na rumeni oropiment, ki je alkimisti predstavljala glavno obliko uporabe arzena.
Arzen že dolgo, preden je bil prepoznan kot kemični element, je bil znan in uporabljen v obliki svojih spojin. Na primer Aristotel v četrtem stoletju.C. Pisal je o sandarache, snovi, za katero se zdaj misli, da gre za arzen sulfid.
Plinio El Viejo in Pivanio Discorides, v 1. stoletju.C., Opisali so oropiment, mineral, ki ga sestavlja2S3. V enajstem stoletju so bile prepoznane tri vrste arzena: bele (kot4Tudi4), Rumena (kot2S3) in rdeče (kot4S4).
Arsen kot čisti element je prvič opazil Albertus Magnus (1250). Magnus ogrevan arzenski sulfid z milom, ki opazi videz snovi z značilnostjo, podobno sivi -gray slike slike. Vendar je prvo avtentično poročilo o njegovi izolaciji leta 1649 objavil Johann Schroeder, nemški farmacevt.
Schroeder je pripravil arzen s segrevanjem svojega premogovnega oksida. Nato je Nicolasu Lémeryju uspelo ogreti z segrevanjem mešanice arzenskega oksida, mila in kalije. V 18. stoletju je bil ta element končno priznan kot semimetal.
Lahko vam služi: brez elektrolitov: značilnosti in primeriArzenska struktura
Arzen je izomorfni do antimona; To je, strukturno so enaki, razlikujejo se le v velikosti svojih atomov. Vsak atom arzena tvori tri kovalentne vezi kot kovalentne vezi, tako da izvirajo tudi v šesterokotnih enotah6 "Nagubana ali strma", saj je hibridizacija atomov SP3.
Potem enote6 Povezujejo se, da povzročajo strme arzenske plasti, ki šibko delujejo med seboj. Po njihovih medmolekularnih silah, ki so odvisni predvsem od njihovih atomskih mas.
Mogoče zaradi odbojnosti arzenskih elektronov, enot6 Oblikovani med vzporednimi plastmi ne definirajo popolnega oktaedra, ampak izkrivljajo:
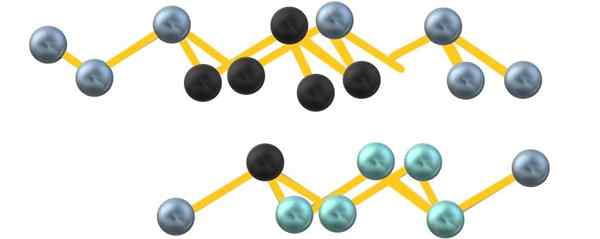 Siva arzena kristalna struktura. Vir: Gabriel Bolívar.
Siva arzena kristalna struktura. Vir: Gabriel Bolívar. Upoštevajte, da črne sfere narišejo popačeno ravnino v prostoru med dvema strmih slojih. Tudi v spodnjem sloju so modrikaste sfere, ki si poleg črne krogle sestavljajo enoto6 omenjeno na začetku oddelka.
Struktura je videti urejena, vrstice se dvigajo in spustijo, zato je kristalna. Vendar lahko postanete amorfni, z stisnjenimi sferami različnih načinov. Ko sivkast arzen postane amorfna, postane polprevodnik.
Rumeni arzen
Rumena arzen, najbolj strupena alotropna tega elementa, je zgolj molekularna snov. Sestavljajo kot molekule4 enote s šibkimi disperzijskimi silami, ki jim ne preprečujejo, da bi nestabilno.
Črni arzen
Črni arzen je amorfni; Ampak ne kako je lahko sivkasto alotrop. Njegova struktura je nekoliko podobna nedavnemu6 Imajo večja področja in različne motnje.
Elektronska konfiguracija
[AR] 3D104s24p3
Imajo vse orbitale na ravni 3 polne. Obrazecne povezave z uporabo 4S in 4P orbital (pa tudi 4D) z različnimi kemičnimi hibridizacijami.
Lastnosti
Molekularna teža
74.922 g/mol
Fizični opis
Siva arzen je sivkasto kovinsko trdna in krhka konsistenca.
Barva
Tri alotropne oblike, rumene (alfa), črna (beta) in siva (gama).
Vonj
Stranišče
Okus
Brez okusa
Tališče
1.090 K pri 35,8 atm (trojna arzena točka).
Pri običajnem tlaku nima fuzijske točke, saj se sublimira 887 K.
Gostota
-Sivi arzen: 5,73 g/cm3.
Lahko vam služi: karbonilna skupina: značilnosti, lastnosti, nomenklatura, reaktivnost-Rumena arzen: 1,97 g/cm3.
Topnost vode
Nerešljiv
Atomski radio
139 popoldne
Atomski volumen
13,1 cm3/mol
Radijski kovalent
120 popoldne
Specifična toplota
0,328 j/g · mol pri 20 ° C
Toplota izhlapevanja
32,4 kJ/mol
Elektronegativnost
2,18 na lestvici Pauling
Ionizacijska energija
Prva ionizacijska energija 946,2 kJ/mol
Stanja oksidacije
-3, +3, +5
Stabilnost
Elementalni arzen je stabilen na suhem zraku, ko pa je izpostavljen vlažnemu zraku2Tudi3).
Razgradnja
Ko se arzen segreje na razgradnjo, oddaja beli dim iz AS2Tudi3. Postopek je nevaren, ker se lahko oddaja tudi Arsina, zelo strupen plin.
Samo-usmeritev
180 ° C
Trdota
3.5 na lestvici trdote MOHS.
Reaktivnost
Ne napade ga hladna žveplova kislina ali koncentrirana klorovodikova kislina. Reagira z dušikovo kislino ali vročo žveplovo kislino, ki tvori arsenozno kislino in arzenovo kislino.
Ko se sivi arzen hlapnira s segrevanjem in se hlapi hitro ohladi, se tvori rumeni arzen. To se vrne v sivkasto obliko, če je podvrženo ultravijolični svetlobi.
Prijave
Zlitine
Majhna količina arzena, dodana za svinec, utrdi zlitine dovolj, da jih lahko uporabi pri oblogi kablov in pri izdelavi avtomobilskih baterij.
Dodajanje arzena medenine, zlitine bakra in cinka, poveča njegovo odpornost na korozijo. Po drugi strani pa popravi ali zmanjša izgubo cinka v medenini, kar povzroči povečanje njegove koristne življenjske dobe.
Elektronika
Prečiščeni arzen se uporablja v polprevodniški tehnologiji, kjer se uporablja v povezavi z Gallic.
Gaas imajo neposreden interval pasu, ki ga je mogoče uporabiti pri proizvodnji diod, laserja in LED. Poleg Gallium arseniuro obstajajo tudi drugi arseniuros, kot sta indijski arseniuro in aluminijski arseniuro, ki predstavljajo tudi polprevodnike II-V.
Medtem je kadmij arseniuro polprevodnik tipa II-IV. Arsina je bila uporabljena v polprevodniškem dopingu.
Kmetijstvo in ohranjanje lesa
Večina aplikacij je bila zavržena zaradi svoje velike strupenosti in njihovih spojin. As2Tudi3 je bil uporabljen kot pesticid, medtem ko as2Tudi5 Je sestavina herbicidov in insekticidov.
Arsenočna kislina (h3ASO4) in soli, kot sta kalcij in svinčen arzenat, so bile uporabljene za sterilizacijo tal in zatiranje škodljivcev. To povzroča tveganje za onesnaževanje okolja z arzenom.
Vam lahko služi: tekoči elementi: kaj so in primeriGlavni arseniato je bil do prve polovice dvajsetega stoletja uporabljen kot insekticid pri sadnih drevesih. Toda zaradi svoje strupenosti ga je nadomestil natrijev metilarsenat, ki se je od istega razloga prenehal uporabljati od leta 2013.
Zdravilno
Do dvajsetega stoletja je bilo več njihovih spojin uporabljeno kot zdravila. Na primer, Arsfenamina in Neolsalvarsan sta bila uporabljena pri zdravljenju sifilisa in triposomiaze.
Leta 2000 je bila odobrena uporaba AS2Tudi3, Zelo strupena spojina pri zdravljenju akutne promineo odporne na retino-trans kisle kisline. Pred kratkim je bil uporabljen radioaktivni izotop 74Kar zadeva lokacijo tumorjev.
Izotop ustvarja dobre slike, jasnejše od tistih, pridobljenih z 124I, ker jod odpelje na ščitnico in proizvaja hrup v signalu.
Druge uporabe
Arzen je bil v preteklosti uporabljen kot aditivni vir pri proizvodnji perutnine in prašičev.
Uporablja se kot katalizator v proizvodnji etilen oksida. Uporablja se tudi v pirotehniki in porjavi. Arsenioso oksid se uporablja kot dekolorant v proizvodnji stekla.
Kje je?
Arzen lahko najdemo v majhnih količinah v osnovnem stanju z visoko stopnjo čistosti. Prisoten je v številnih spojinah, kot so: sulfidi, arsenuros in sulfarseniuros.
Najdemo ga tudi v več mineralih, vključno z: arsenopirit (FESAS), Loellingta (grda2), Enargita (Cu3Rit4), Oropiment (kot2S3) In rejalgar (kot4S4).
Kako je pridobljeno?
Arsenopirita se segreje na 650-700 ° C, če ni zraka. Arzen izhlapi in pušča železni sulfid (FES) kot ostanek. Med tem postopkom se arzen veže na kisik4Tudi6, znan kot "beli arzen".
As4Tudi6 Je spremenjen tako, da tvori as2Tudi3, katerih hlapi so zbrani in kondenzirani v naboru opečnih kamer, s čiščenjem arzena s sublimacijo.
Večina arzena nastane z zmanjšanjem ogljika prahu, ki nastane2Tudi3.
Reference
- Stephen r. Marsden. (23. april 2019). Kemija arzena. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (3. december 2018). Zanimiva dejstva o arzenu. Okreval od: Thoughtco.com
- Wikipedija. (2019). Arzen. Pridobljeno iz: v.Wikipedija.org
- Doktor. Testo Stewart. (2019). Dejstva o arzenih elementih. Kemikool. Okrevano od: Chemicool.com
- Royal Society of Chemistry. (2019). Arzen. Okrevano od: RSC.Ali
- Uredniki Enyclopeedia Britannica. (3. maj 2019). Arzen. Encyclopædia Britannica. Okrevano od: Britannica.com
- « Značilnosti manjšinske skupine, vrste, primeri
- Reynolds številke Za kaj je, kako je izračunano, vaje »

