Amine

- 1617
- 393
- Adrian Legros
Kaj so amini?
The amine So organske spojine, ki izhajajo iz amoniaka. V njih so kovalentni sindikati med ogljikom in dušikom. Seveda je molekula dušika kinetično inertna; Toda zahvaljujoč biološki fiksaciji postane amonijak, ki posledično trpi naknadne alkilacijske reakcije.
Ko je amoniak "najet", nadomesti enega, dva ali tri od treh vodikov z ogljikovimi atomi. Ti ogljikovi lahko prihajajo iz najemne skupine (R) ali Aryl (AR). Tako obstajajo alifatski amini (linearni ali razvejani) in aromatični.
Amini so močnejše organske baze kot isti amonijak. Iz rastlinske snovi jih je enostavno odstranljiv in imajo na splošno močne interakcije z nevronsko matrico organizmov; Zato je veliko zdravil in zdravil sestavljen iz aminov s kompleksnimi strukturami in substituent.
Aminska struktura
 Splošna formula za amin. Vir: Mache, Wikimedia Commons.
Splošna formula za amin. Vir: Mache, Wikimedia Commons. Čeprav se razlikuje glede na naravo R, je elektronsko okolje dušikovega atoma enako za vse: tetraedra. Toda, če ima nekaj elektronov, ki se ne delijo na dušikovem atomu (··), molekularna geometrija postane piramidalna. To je tako z amonijakom in amini.
Amine je mogoče predstaviti s tetraedrom, pa tudi, kot je to narejeno z ogljikovimi spojinami. Tako, nh3 in pogl4 Narisani so kot tetraedri, kjer se par (··) nahaja v enem od tokov nad dušikom.
Obe molekuli sta akvaralni; Vendar začnejo predstavljati kiralnost, ko njihov H nadomešča. Amina r2NH je akviralna, če sta dva R različna. Vendar nima nobene konfiguracije, da bi razlikoval enantiomer od drugega (kot se to dogaja s kiralnimi ogljikovimi centri).
To je zato, ker enantiomeri:
R2N-h | H-NR2
Izmenjujejo jih s hitrostjo, da niti ne morejo izolirati; in zato se strukture aminov štejejo za akvarije, tudi če so vsi substituenti v dušikovem atomu različni.
Amin lastnosti
Polarnost
Amini so polarne spojine, saj je skupina Amino NH2, Za atom elektronegativnega dušika prispeva k dipolnemu trenutku molekule. Upoštevajte, da ima dušik sposobnost darovanja vodikovih vezi, ki imajo na splošno visoke vrele in fuzijske točke.
Fizične značilnosti
V svetu kemije, ko govori o aminu, se pojavi nehoteno dejanje pokrivanja nosu. To je zato, ker imajo na splošno neprijetne vonjave, od katerih se nekateri zdijo gnili ribe.
Lahko vam služi: Maillard ReakcijaPoleg tega imajo tekoči amini ponavadi rumenkaste odtenke, ki povečajo vizualno nezaupanje, ki ga ustvarijo.
Topnost vode
Amini so ponavadi netopni v vodi, ker kljub temu, da lahko s H₂o tvorijo vodikove mostove, je njegova večinska organska komponenta hidrofobna. Bolj kot so zajetne ali dolge skupine R, manj bo njihova topnost v vodi.
Ko pa je na sredini kislina, se topnost poveča s tvorbo, ki je znano kot aminske soli. V njih ima dušik pozitivno delno obremenitev, kar elektrostátično privabi na anionsko ali kislinsko konjugatno bazo.
Basicy
Amini so močnejše organske baze kot amonijak. Večja kot je elektronska gostota okoli dušikovega atoma, bolj osnovna bo; to pomeni, da bodo kisline medija hitreje neprotrononirale. Če je amin zelo osnovna, lahko celo odvzame proton iz alkoholov.
Vrste (primarni, sekundarni, terciarni)
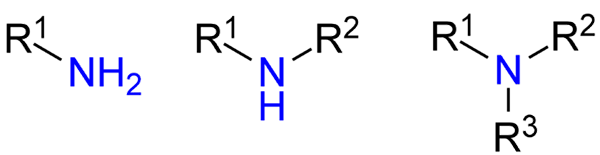 Vrste aminov. Vir: Jü prek Wikipedije.
Vrste aminov. Vir: Jü prek Wikipedije. Čeprav niso bili uradno predstavljeni, so se sklicevali na primarne, sekundarne in terciarne amine (zgornja slika, od leve proti desni).
Primarni amini (RNH2) so monosustuidas; Sekundarna (r2NH), se raztopijo, z dvema r almile ali arilnimi skupinami; in terciar (r3N), so trisustuidni in nimajo vodika.
Vsi obstoječi amini izhajajo iz teh treh vrst, zato so njihova raznolikost in interakcije z biološko in nevronsko matrico ogromne.
Na splošno bi lahko pričakovali, da bodo terciarni amini najosnovnejši; Vendar takšne izjave ni mogoče dati, ne da bi poznali strukture R.
Oblikovanje aminov
Alkilacija amoniaka
Sprva je bilo omenjeno, da amini izhajajo iz amoniaka; Zato je najpreprostejši način njihovega oblikovanja z njihovo alkilacijo. Če želite to narediti, se presežek amoniaka reagira z alkil halogenidom, ki mu sledi dodajanje baze za nevtralizacijo aminske soli:
Nh3 + Rx => rnh3+X- => Rnh2
Upoštevajte, da ti koraki vodijo do primarne amine. Lahko se oblikujejo tudi sekundarni in celo terciarni amini, zato se zmogljivost za en sam izdelek zmanjša.
Nekatere metode usposabljanja, na primer Gabrijelova sinteza, omogočajo pridobivanje primarnih aminov, tako da se drugi nezaželeni izdelki ne oblikujejo.
Vam lahko služi: etilni alkohol: struktura, lastnosti, uporabe, pridobivanjePrav tako se lahko ketone in aldehidi zmanjšajo v prisotnosti amoniaka in primarnih aminov, kar povzroči sekundarne in terciarne amine.
Katalitična hidrogenacija
Nitro spojine se lahko zmanjšajo v prisotnosti vodika in katalizatorja za pretvorbo v ustrezne amine.
Arno2 => Rnah2
Nitrilos, rc≡n in amidas, rconr2, Zmanjšajo se tudi, da dajo primarne in terciarne amine.
Nomenklatura
Kako se imenujejo amini? Večino časa so imenovani v skladu z R, Aquilo ali Aryl Group. Na ime R, izhaja iz njegovega alkana, mu na koncu doda beseda "amine".
Tako, pogl3Pogl2Pogl2Nh2 Je propilamin. Po drugi strani pa ga lahko imenujemo samo alkan in ne kot R skupina: propanamin.
Prvi način, da jih poimenujemo, je toliko znan in uporabljen.
Ko obstajata dve skupini NH2, Alkane je imenovan in našteti položaji amino skupin. Tako, h2NCH2Pogl2Pogl2Pogl2Nh2 Imenuje se: 1.4-butanodiamine.
Če obstajajo oksigenirane skupine, kot je OH, je treba prednostno dati NH2, ki je imenovana za substituent. Na primer hoch2Pogl2Pogl2Nh2 se imenuje: 3-aminopropanol.
In glede na sekundarne in terciarne amine so črke N narejene tako, da označujejo skupine R. Najdaljša veriga bo obdržala ime spojine. Tako, cho3NHCH2Pogl3 Imenuje se: n-metiletilamin.
Uporaba aminov
Barvila
Primarni aromatični amini lahko služijo kot začetni material za sintezo azo barvil. Sprva se amini reagirajo na tvorbo diazonijevih soli, ki tvorijo spojine s kopulacijo strehe (ali diazojsko sklopko).
Zaradi intenzivnega obarvanosti se v tekstilni industriji uporabljajo kot material za barvanje; Na primer: metilna oranžna, rjava 138 neposredna, rumena sončna FCF in Ponceau.
Droge in droge
Številna zdravila delujejo z agonisti in antagonisti naravnih aminskih nevrotransmiterjev. Primeri:
-Klorofeniramin je antihistaminik, ki se uporablja pri nadzoru alergijskih procesov zaradi vnosa nekaterih živil, senene mrzlice, žuželke itd.
-Klorpromazin je sedativni sredstvo, ne induktor za spanje. Olajša tesnobo in se celo uporablja pri zdravljenju nekaterih duševnih motenj.
-Efedrin in fenimfedrin se uporabljata kot dekongestavca dihalnega trakta.
Vam lahko služi: osmolarnost-Amitriptalin in imipramin sta terciarni amini, ki se uporabljajo pri zdravljenju depresije. Triciklični antidepresivi so razvrščeni po njihovi strukturi.
-Opioidni analgetiki, kot so morfij, kode in heroin, so terciarni amini.
Obdelava plina
Pri izločanju ogljikovih dioksidnih plinov se uporablja več aminov, vključno z diglikolaminom (DGA) in dietolaminom (DEA) (CO2) in vodikov sulfid (h2S) prisoten v zemeljskem plinu in rafinerijah.
Kmetijska kemija
Metilamini so posredniške spojine v sintezi kemikalij, ki se uporabljajo v kmetijstvu, kot so herbicidi, fungicidi, insekticidi in biocidi.
Proizvodnja smol
Metilamini se uporabljajo med izdelavo ionskih menjalnih smol, uporabne pri deionizaciji vode.
Živalska hranila
Trimetilamin (TMA) se uporablja predvsem pri proizvodnji kloridnega klorida, dodatka vitamina B, ki se uporablja pri piščancih, puranih in prašičih.
Gumijasta industrija
Olje dimetilamina (DMA) je emulgator za uporabo v proizvodnji sintetične gume. DMA se uporablja neposredno kot modifikator polimerizacije v parni fazi butadiena in kot stabilizator lateksa naravnega guma namesto amoniaka
Topila
Dimetilamin (DMA) in monometilamin (MMA) se uporabljata za sintezo timetilformamidnih polarnih polarnih topil (DMF), dimetilacetamida (DMAC) in N-metilridona (NMP) (NMP) (NMP).
Med aplikacijami DMF vključujejo: uretansko prevleko, akrilno topilo preje, reakcijska topila in ekstrakcijska topila.
DMAC se uporablja pri proizvodnji barvil in preje. Končno se NMP uporablja pri rafiniranju mazivnih olj, prevzem in prevleke za sklenivanje.
Primeri aminov
Kokain
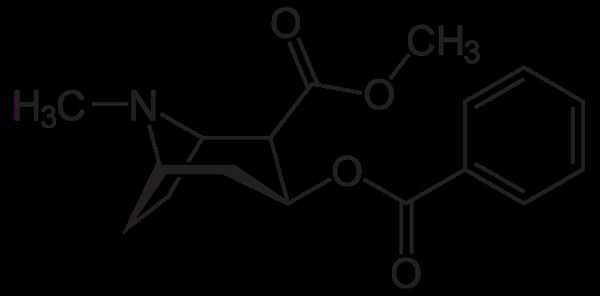 Molekula kokaina. Neurotokeker, Wikimedia Commons
Molekula kokaina. Neurotokeker, Wikimedia Commons Kokain se uporablja kot lokalni anestetik pri določenih vrstah očesnih operacij, ušes in grla. Kot je razvidno, je terciarni amin.
Nikotin
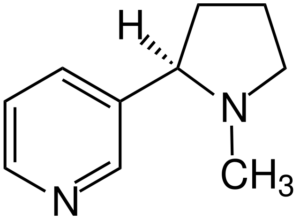 Nikotinska molekula. Vir: Jü [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons
Nikotinska molekula. Vir: Jü [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons Nikotin je glavni povzročitelj odvisnosti od tobaka in kemično terciarni amin. Nikotin, prisoten v tobačnem dimu, se hitro absorbira in je zelo strupen.
Morfij
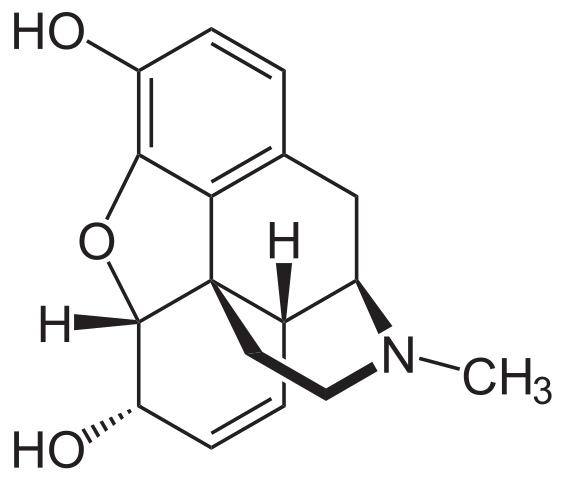 Morfijska molekula. Vir: Neurotoger [Public Domain], iz Wikimedia Commons
Morfijska molekula. Vir: Neurotoger [Public Domain], iz Wikimedia Commons Je eden najučinkovitejših analgetikov za lajšanje bolečin, zlasti raka. Spet je terciarni amin.
Serotonin
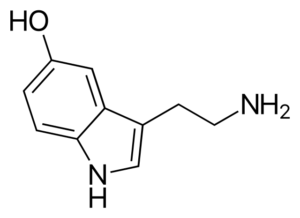 Molekula serotonina. Vir: Harbin [Public Domain], iz Wikimedia Commons
Molekula serotonina. Vir: Harbin [Public Domain], iz Wikimedia Commons Serotonin je aminski nevrotransmiter. Pri depresivnih bolnikih se koncentracija glavnega metabolita serotonina zmanjša. Za razliko od drugih aminov je to primarno.
Reference
- Metilamini: uporabe in aplikacije. Okrevano od: kemourne.com
- Raziskave trga za preglednost. (s.F.). Amini: pomembna dejstva in uporabe. Okrevano od: TransparencyMarketResearch.com

