Etil acetat
- 1886
- 352
- Adrian Legros
On etil ali etil etana acetata Gre za organsko spojino, katere kemična formula je CHO3Cooc2H5. Sestavljen je iz estra, kjer alkoholna komponenta izhaja iz etanola, medtem ko njegova komponenta karboksilne kisline prihaja iz ocetne kisline.
To je tekočina v normalnih temperaturnih in tlačnih pogojih, ki aromo predstavlja prijetno sadjem. Ta lastnost popolnoma vstopi v harmonijo, zato se pričakuje od estra; kar je v resnici kemična narava etil acetata. Zaradi tega najde uporabo v živilskih izdelkih in alkoholnih pijačah.
 Etil acetat. Vir: Commons Wikimedia.
Etil acetat. Vir: Commons Wikimedia. Zgornja slika prikazuje skeletno strukturo etil acetatode. Upoštevajte njegovo komponento karboksilne kisline, na desni pa alkoholno komponento. S strukturnega vidika bi lahko pričakovali, da se bo ta spojina obnašala kot hibrid med kisom in alkoholom; Vendar ima svoje lastnosti.
Tukaj izstopajo takšni hibridi, imenovani estri, da so drugačni. Etil acetat ne more reagirati kot kislina, niti dehidriranja z odsotnostjo skupine OH. Namesto tega trpi osnovno hidrolizo v prisotnosti močne baze, kot so natrijev hidroksid, NaOH.
Ta reakcija hidrolize se uporablja pri poučevanju laboratorijev za poskuse s kemijsko kinetiko; kjer je reakcija poleg tega drugo red. Ko pride do hidrolize, Ethilov etanoat.
V svojem strukturnem okostju je opaziti, da vodikovi atomi na kisiku prevladujejo. To vpliva na njegovo sposobnost interakcije z ne kot polarnimi vrstami kot maščobami. Uporablja se tudi za raztapljanje spojin, kot so smole, barvila in v splošnih organskih trdnih snovi.
Kljub prijetni aromi, dolgotrajna izpostavljenost tej tekočini povzroči negativen udar (kot skoraj vse kemične spojine) na telesu.
Struktura etil acetata
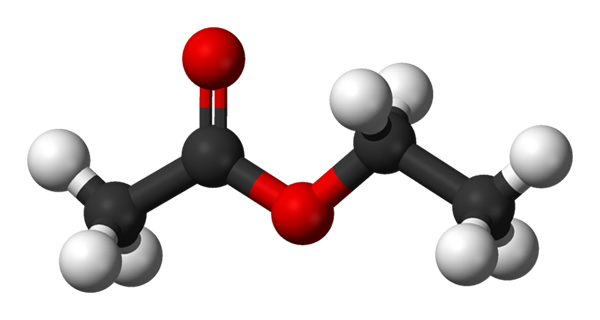
 Kroglice in palice za etil acetat. Vir: Benjah-BMM27 [javna domena]
Kroglice in palice za etil acetat. Vir: Benjah-BMM27 [javna domena] Zgornja slika prikazuje strukturo etil acetata z modelom kroglic in palic. V tem modelu so poudarjeni kisikovi atomi z rdečimi kroglami; Na levi strani je delež, ki izhaja iz kisline, na desni pa frakcija, ki izhaja iz alkohola (Alcoxi, -or).
Vam lahko služi: šibki elektroliti: koncept, značilnosti, primeriKarbonilno skupino si lahko ogledate s povezavo c = o (dvojne palice). Struktura okoli te skupine in sosednjega kisika je ravna, ker obstaja resonančna obremenitev med obema kisikom; Dejstvo, ki pojasnjuje razmeroma nizko kislost α hidrogenov (tistih iz skupine -CH3, povezan s c = o).
Molekula, ki se vrti dve njegovi povezavi, neposredno daje prednost, kako deluje z drugimi molekulami. Prisotnost obeh kisikovih atomov in asimetrija v strukturi ji dajeta trajni dipolski trenutek; kar je posledično odgovorno za svoje interakcije dipol-dipola.
Na primer, elektronska gostota je večja v bližini dveh atomov kisika, v skupini -CH pa se znatno zmanjša3, In postopoma v skupini OCH2Pogl3.
Zaradi teh interakcij molekule etil acetata v normalnih pogojih tvorijo tekočino, ki ima znatno visoko vrelišče (77 ° C).
Odsotnost atomov darovalcev vodikovih mostov
Če se struktura skrbno opazi, bo opažena odsotnost atoma, ki lahko podari vodikov most. Vendar so kisikovi atomi sprejemniki takšnih, etil acetat pa je zelo topen v vodi in se do kontirane stopnje medsebojno spopada s polarnimi spojinami in darovalci vodikovih mostov (kot so sladkorji).
Prav tako vam omogoča, da odlično komunicirate z etanolom; razlog, zakaj njena prisotnost v alkoholnih pijačah ni presenečena.
Po drugi strani pa njegova skupina Alcoxi omogoča interakcijo z določenimi apolarnimi spojinami, kot so kloroform, ch3Cl.
Fizikalne in kemijske lastnosti
Imena
-Etil acetat
-Etil etanoat
-Ocetni etil
-Acetoxietano
Molekularna formula
C4H8Tudi2 ali pogl3Cooc2H5
Molekularna teža
88,106 g/mol.
Fizični opis
Prozorna brezbarvna tekočina.
Barva
Brezbarvna tekočina.
Vonj
Značilno za ethers, podobno kot vonj ananasa.
Okus
Lepo, ko ga razredčimo, pivo prinese sadni okus.
Prag vonja
3,9 ppm. 0,0196 mg/m3 (nizek vonj); 665 mg/m3 (Visok vonj).
Vam lahko služi: kemična vezOdkrit vonj pri 7 - 50 ppm (povprečje = 8 ppm).
Vrelišče
171 ° F pri 760 mmHg (77,1 ° C).
Tališče
-118,5 ° F (-83,8 ° C).
Topnost vode
80 g/l.
Topnost v organskih topilih
Mešan z etanolom in etilnim etrom. Zelo topen v acetonu in benzenu. Mešljiv s kloroformom, fiksnimi olji in hlapnimi ter tudi s kisikom in kloriranimi topili.
Gostota
0,9003 g/cm3.
Gostota pare
3.04 (v zračnem razmerju: 1).
Stabilnost
Počasi razpade z vlago; nezdružljivo z več močnimi oksidacijskimi plastiki in sredstvi. Zmes z vodo je lahko eksploziven.
Parni tlak
93,2 mmHg pri 25 ° C
Goo
0,423 mpoise pri 25 ° C.
Toplota zgorevanja
2.238,1 kJ/mol.
Toplota za uparjanje
35,60 kJ/mol pri 25 ° C.
Površinska napetost
24 dinas/cm pri 20 ° C.
Lomni količnik
1,373 do 20 ° C/D.
Temperatura skladišča
2 - 8 ° C.
PKA
16 - 18 do 25 ° C.
Sinteza
Fisherjeva reakcija
Etil acetat se industrijsko sintetizira z Fisherjevo reakcijo, pri katerem etanol esterificiramo z ocetno kislino. Reakcija se izvaja pri sobni temperaturi.
Pogl3Pogl2Oh +ch3COOH CH3Cooch2Pogl3 + H2Tudi
Reakcija pospešuje s kislinsko katalizo. Ravnotežje se premakne v desno, torej proti proizvodnji etil acetata, z odstranjevanjem vode; V skladu z zakonom o množičnih ukrepih.
Reakcija Tishchenko
Etil acetat se pripravlja tudi industrijsko z uporabo reakcije Tishchenko in konjugira dva ekvivalenta acetaldehida z uporabo katalizatorja katalizatorja.
2 pogl3CHO => CHO3Cooch2Pogl3
Druge metode
-Etil acetat se sintetizira kot ko -produkt pri oksidaciji butana do ocetne kisline, v reakciji, narejeni pri temperaturi 175 ° C in 50 atm tlaka. Uporablja se kot kobaltni katalizator in kromirani ioni.
-Etil acetat je Co -produkt polivinil polivinil acetat etanola.
-Etil acetat se v industriji proizvaja tudi z dehidrogenacijo etanola, kataliziranje reakcije z uporabo bakra pri visoki temperaturi, vendar manj kot 250 ° C.
Prijave
Topilo
Etil acetat se uporablja kot topilo in redčenje z uporabo čiščenja vezja. Uporablja se kot topilo pri izdelavi modificiranega ekstrakta hmelja in v kavi in čajnih listih brez kofeina. Uporablja se v črnilih, ki se uporabljajo za označevanje sadja in zelenjave.
Lahko vam služi: cianhidrična kislina: molekularna struktura, lastnosti, uporabeEtil acetat se v tekstilni industriji uporablja kot čistilno sredstvo. Se uporablja pri kalibraciji termometrov, ki se uporablja pri ločevanju sladkorjev. V industriji barv se uporablja kot topilo in redčenje uporabljenih materialov.
Umetni okusi
Uporablja se pri izdelavi sadnih okusov; Na primer: banana, hruška, breskev in ananas, pa tudi grozdna aroma itd.
Analitika
Uporablja se pri določanju bizmuta, bora, zlata, molibdena in platine, pa tudi topila taliva. Etil acetat ima sposobnost pridobivanja številnih spojin in elementov, ki so prisotni v vodni raztopini, kot so: fosfor, kobalt, volfram in arzen.
Organska sinteza
Etil acetat se v industriji uporablja kot reduktor pri viskoznosti smol, ki se uporabljajo v formulacijah fotorestoniranja. Uporablja se pri proizvodnji acetamida, acetil acetatu in metil heptanonu.
Kromatografija
V laboratorijih se etil acetat uporablja kot mobilna faza kromatografij v stolpcih in kot ekstrakcijsko topilo. Če imate etil acetat relativno nizko vrelišče, je enostavno izhlapevanje, kar vam omogoča, da v topilu koncentrirate raztopljene snovi.
Entomologija
Etil acetat se v entomologiji uporablja za zadušitev žuželk, nameščenih v posodo, kar omogoča njegovo zbiranje in študij. Etil acetatni hlapi ubijejo žuželko, ne da bi jo uničili in se izognili njihovi otrditvi, kar olajša njihovo zbirko.
Tveganja
-LDpetdeset Iz etil acetata pri podganah kaže na nizko strupenost. Vendar lahko draži kožo, oči, kožo, nos in grlo.
-Izpostavljenost visokim nivojem lahko povzroči omotico in omedlela. Prav tako lahko dolgoročna izpostavljenost vpliva na jetra in ledvice.
-Inhalacijo etil acetata pri koncentraciji 20.000 - 43.000 ppm lahko proizvaja pljučni edem in krvavitev.
-Omejitev razstave delovne sile je OSHA postavila 400 ppm v zraku v povprečju med 8 -urno delovno izmeno.
Reference
- Ilustrirani slovar organske kemije: etil acetat (ETOAC). Okrevano od: kem.UCLA.Edu
- Etil acetat. Pridobljeno iz: chm.Bris.AC.Združeno kraljestvo

