Alkynes
- 3648
- 365
- Don Nitzsche
 Alvento struktura s trojno povezavo
Alvento struktura s trojno povezavo Kaj so alkini?
The Alkynes So ogljikovodiki ali organske spojine, ki v njihovih strukturah predstavljajo trojno povezavo med dvema ogljikoma. Ta trojna povezava (≡) se šteje za funkcionalno skupino, kadar predstavlja aktivno mesto molekule, zato je odgovorna za njihovo reaktivnost.
Čeprav se alkini ne razlikujejo veliko od alko ali alkenov, kažejo večjo kislost in polarnost zaradi narave njihovih povezav. Natančen izraz za opis te majhne razlike je tisto, kar je znano kot nenasičenje.
Alkani so nasičeni ogljikovodiki, medtem ko so alkini najbolj nenasičeni glede na prvotno strukturo. Kaj to pomeni? Da alkan h3C-ch3 (etan) je lahko dehidrogen na h2C = pogl2 (etene) in posledično HC≡CH (etino ali bolj znan kot acetilen).
Upoštevajte, kako nastajajo dodatne povezave med ogljikovimi letali. Carbon zaradi svojih elektronskih značilnosti želi oblikovati štiri preproste povezave, zato večja je težnja po reakciji (razen aromatičnih spojin).
Po drugi strani je trojna povezava veliko močnejša od dvojne (=) ali preproste (-) vezi, vendar pri visokih stroških energije. Zato lahko večina ogljikovodikov (alkani in alkeni) tvori trojne vezi pri visokih temperaturah.
Zaradi visokih energij teh, ko se lomijo, sproščajo zelo vroče. Primer tega pojava je razvidno, ko se uporablja acetilen, ki se opeče s kisikom in intenzivno toploto plamena do kovine zvara ali taljenja.
Acetilen je najpreprostejši in najbolj majhen alkin od vseh. Druge ogljikovodike se lahko izražajo iz njihove kemijske formule z nadomeščanjem H z alkičnimi skupinami (RC≡CR '). Enako se zgodi v svetu organske sinteze z velikim številom reakcij.
Ta alkin se pojavlja iz reakcije kalcijevega oksida apnenca in koka, surovine, ki zagotavlja potrebne ogljike znotraj električne pečice:
CaO + 3C => CAC2 + Co
CAC2 To je kalcijev karbid, anorganska spojina, ki končno reagira z vodo, da tvori acetilen:
Cac2 + 2H2O => ca (OH)2 + HC≡CH
Fizikalne in kemijske lastnosti alkinov
Polarnost
Trojna povezava razlikuje alkine od alkanov in alkenov. Tri vrste ogljikovodikov so apolarne, netopne v vodi in zelo šibke kisline. Vendar je elektronegativnost ogljikovih in trojnih vezi večja kot pri preprostih ogljikih.
V skladu s tem so ogljiki, ki mejijo na donosnost trojne vezi z induktivnim učinkom negativne gostote obremenitve. Zaradi tega, če so povezave C≡C ali C = C. Posledično obstaja majhen dipolni trenutek, ko molekule delujejo s sili dipola-dipolo.
Te interakcije so zelo šibke, če se njihovi dipolni trenutki primerjajo s tistimi iz molekule vode ali alkoholom. To se odraža v njihovih fizikalnih lastnostih: alkini imajo na splošno višje fuzijske in vrelišča v primerjavi s tistimi manj nenasičenih ogljikovodikov.
Vam lahko služi: 7 najpomembnejših aplikacij za biokemijoPrav tako so zaradi nizke polarnosti manj nerešljive v vodi, vendar topni v apolarnih organskih topilih, kot je benzen.
Kislost
Tudi ta elektronegativnost povzroči vodik Hc≡CR je bolj kislo kot kdorkoli prisoten v drugih ogljikovodikov. Zato so alkini vrste bolj kisle kot alkeni in veliko več kot alkani. Vendar njegova kislost ostane zaničljiva, če v primerjavi s karboksilnimi kislinami.
Ker so alkini zelo šibke kisline, reagirajo le z zelo močnimi osnovami, kot je natrij amiduro:
HC≡CR + nanh2 => HC≡CNA + NH3
Iz te reakcije dobimo raztopino natrijeve acetilure, surovina za sintezo drugih alkinov.
Alquinosova reaktivnost
Reaktivnost alkinov je razložena z dodajanjem majhnih molekul v njihovo trojno povezavo, kar zmanjša njegovo nenasičenost. To so lahko vodikove molekule, vodikove hallogenide, voda ali halogeni.
Hidrogenacija
Mala h molekula2 Je zelo nedostopno in hitro, tako da povečate možnosti, da bi bili dodani v trojno povezavo Alkinov.
Običajno so to kovine (PD, PT, RH ali NI) fino razdeljene, da povečajo površino; In na ta način stik med vodikom in Alquino:
RC≡CR ' + 2H2 => Rch2Pogl2R '
Rezultat tega je, da je vodik "sidranje" do ogljikovih, ki lomijo vez, in tako naprej, dokler ustrezni alkan ne nastane, RCH2Pogl2R '. To ne samo nasiči začetnega ogljikovodika, ampak tudi spremeni njegovo molekularno strukturo.
Dodajanje vodika halogenuros
Tu je dodana anorganska molekula HX, kjer je X lahko kateri koli od halogenov (F, CL, BR ali I):
RC≡CR ' + HX => rch = cxr'
Hidracija
Hidracija alkinov je, ko dodajo molekulo vode, da tvorijo aldehid ali keton:
RC≡CR ' + H2O => rch2Kor
Če je r 'h, je to aldehid; Če gre za najemnino, potem je cetona. V reakciji se kot posrednik tvori spojina, znana kot Enol (RCH = C (OH) R ').
To trpi pretvorbo enolične oblike (C-OH) v keton (C = O) v ravnovesju, imenovanem tautomerizacija.
Dodajanje halogenov
In glede na dodatke lahko diatomske molekule halogenov zasidrate tudi na ogljikovemu ogljiku (x x2= F2, Cl2, Br2 slišal sem2)::
RC≡CR ' + 2x2 => Rcx2-Cx2R '
Acetilen alkilacija
Iz raztopine natrijeve acetilure lahko druge alkine pripravite z uporabo halogenida:
HC≡CNA + RX => HC≡CR + NAX
Na primer, če bi šlo za metil jodid, potem bi bil alkin:
Hc≡CNA + ch3I => HC≡CCH3 + Nax
HC≡CCH3 je pravi, znan tudi kot Metilacetilen.
Kemična struktura alkinov
 Kemična struktura Alquino
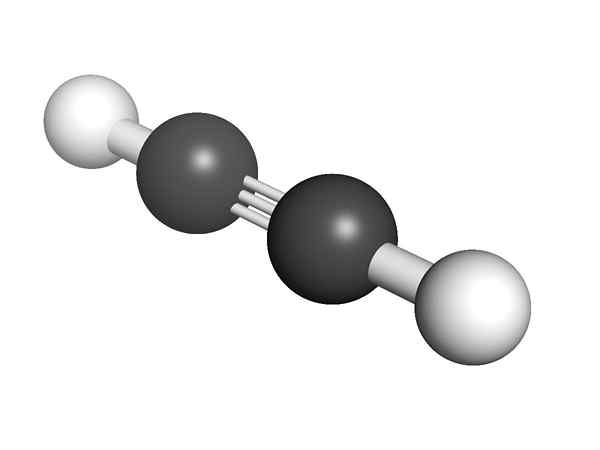
Kemična struktura Alquino Kakšna je struktura alkinov? Na zgornji sliki je prikazana molekula acetilen. Iz nje je lahko jasna linearna geometrija povezave C≡C.
Kadar je trojna vez, mora biti struktura molekule linearna. To je še ena od pomembnih razlik med njimi in ostalimi ogljikovodiki.
Lahko vam služi: cikopropan (C3H6)Alkani so običajno predstavljeni kot cikcaki, ker imajo hibridizacijo SP3 in njihove povezave so ločene 109 °. Pravzaprav so kovalentno združena veriga tetraedre. Medtem ko so alkeni ravni s hibridizacijo SP2 svojih ogljikov, ki tvori natančneje trigonalno ravnino z ločenimi vezmi za 120 °.
V Alkinesu je orbitalna hibridizacija SP, torej ima 50% A in 50% A P. Obstajata dve hibridni orbitali SP, ki sta povezani z atomi H v skupinah acetilena ali alkina v alkinih.
Razdalja obeh H ali R je 180 °, poleg dejstva, da lahko na ta način samo čiste ogljikove orbitale tvorijo trojno vez. Zaradi tega je povezava -C≡C- linearna. Videti strukturo katere koli molekule -C≡C -osvetlitve v tistih regijah, kjer je okostje zelo linearno.
Oddaljenost od povezav in terminalnih milostinj
Carboni v trojni vezi so na manjši razdalji kot v dvojnem ali preprosti povezavi. Z drugimi besedami, C≡C je krajši od C = C in ta C-C. Kot rezultat, je povezava močnejša, ker dve π povezavi prispevata k stabilizaciji preproste povezave σ.
Če je trojna vez na koncu verige, potem je terminalni alkin. Zato mora biti formula omenjene spojine HC≡CR, kjer h pripomni konec ali začetek verige.
Če je nasprotno, je trojna notranja povezava, je formula RC≡CR ', kjer sta R in R' desna in leva stran verige.
Nomenklatura Alkinosa
Kako se alkini imenujejo po pravilih, ki jih narekuje IUPAC? Na enak način, kot sta imenovana Alquenos in Alkenes. Če želite to narediti, se pripona -ano ali -eno za pripono -ino spremeni.
Na primer: HC≡CCH3 Je imenovan nasvete, saj ima tri ogljikove ogljike, na primer propan (CHO3Pogl2Pogl3). HC≡CCH2Pogl3 Je 1-butino, ki je terminalni alkin. Toda v primeru Cho3C≡CCH3 To je 2-butino in v tem Trojna povezava ni končna, ampak notranja.
Pogl3C≡CCH2Pogl2(Pogl3)2 Je 5-metil-2-heksin. Carbons se začne od strani, ki je najbližje trojni povezavi.
Druga vrsta alkinov so cikloalkini. Zanje je dovolj, da pripono -ano zamenjate z -ino ustreznega cikloalkana. Tako je ciklopropan, ki ima trojno vez, poimenovan kot ciklopropin (ki ne obstaja).
Ko obstajata dve trojni povezavi, se imenu doda predpona DI-. Kot primere ima HC≡C-C≡H, diacetilena ali propadina; In na HC≡C-C-Cdajo, butadiino.
Alquinos uporablja
Acetilen ali etino
Najmanjši od alkinov zgosti možno število uporabe teh ogljikovodikov. Iz njega skozi Alks je mogoče sintetizirati druge organske spojine. Med drugim je tudi oksidativne reakcije, da dobimo etanol, ocetno kislino, akrilno kislino.
Vam lahko služi: litijev hidrid: struktura, lastnosti, pridobivanje, uporabeDruge njegove uporabe je zagotavljanje vira toplote za vzbujanje elektronov atomov; bolj specifične, E kovinskih kationov v določanju z atomsko absorpcijsko emisijo, široko uporabljena spektroskopska tehnika.
Naravni alkini
Edine obstoječe metode za pripravo alkinov niso samo sintetične ali s toplotno uporabo, če ni kisika, ampak tudi biološki.
V teh encimih Acetileza, ki lahko zanika dvojno vez. Zahvaljujoč temu se dosežejo številni naravni viri alkinov.
Po tem lahko te vire pridobijo strupe, protidote, zdravila ali katero koli drugo spojino, ki zagotavlja kakršno koli korist; še posebej, če se nanaša na zdravje. Alternative so številne pri spreminjanju izvirnih struktur in jih imajo kot podporo za nove alkine.
Primeri alkinov
Zaenkrat so omenjeni številni primeri alkinov. Vendar nekateri izvirajo iz zelo specifičnih virov ali imajo posebne molekularne strukture: so policetile.
To pomeni, da je lahko več kot trojna povezava, ki je del zelo velike strukture in ne le preproste gazirane verige.
Tarirična kislina
 Struktura tarirične kisline
Struktura tarirične kisline Tarirična kislina prihaja iz rastline, ki se nahaja v Gvatemali, imenovani Picramnia tariri. Posebej izvlečemo iz olja iz njegovih semen.
V svoji molekularni strukturi lahko opazimo eno trojno povezavo, ki loči apolarni rep od polarne glave; Zato bi ga lahko šteli za amfipatično molekulo.
Histrionikotoksin
 Struktura histrionikotoksina
Struktura histrionikotoksina Histrionikotoksin je strup, ki ga ločuje koža prebivalcev Kolumbije, Brazilije in drugih latinskoameriških držav. Ima dve trojni konjugirani povezavi z dvojno vezjo. Oba sta terminala in sta ločena s šestim ogljikom in cikličnim aminom.
Cicutoksin
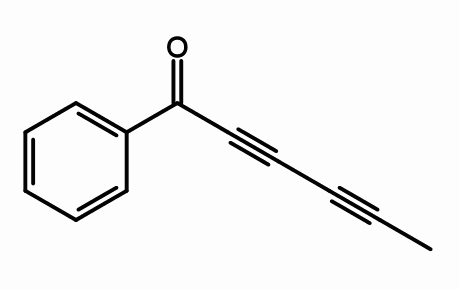 Struktura cikutoksina. Avtor Giorgiogp2 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0) ali gfdl (http: // www.GNU.Org/copyleft/fdl.html)], iz Wikimedia Commons
Struktura cikutoksina. Avtor Giorgiogp2 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0) ali gfdl (http: // www.GNU.Org/copyleft/fdl.html)], iz Wikimedia Commons Iz molekularne strukture cikutoksina, kjer so trojne povezave? Če so dvojne vezi ravne, saj jih vidimo prav, preproste povezave.
Ta spojina je sestavljena iz nevrotoksina, ki ga najdemo predvsem v vodni zdravilni rastlini.
Capillina
 Struktura Capillina. Avtor Klever [CC0], iz Wikimedia Commons
Struktura Capillina. Avtor Klever [CC0], iz Wikimedia Commons To je alkin, ki je prisoten v eteričnem olju rastlin Artemis, ki se uporablja kot protiglivično sredstvo. Opazimo lahko dve trojni zaporedni povezavi, bolj pravilno konjugirani.
Kaj to pomeni? Da trojne vezi odmevajo vzdolž celotne ogljikove verige in vključuje, da se dvojna vez c = o odpre za C-O-.
Pargilin
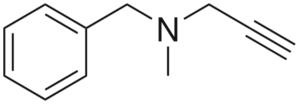 Struktura pargilina
Struktura pargilina Je alty z antihipertenzivno aktivnostjo. Analiziranje njegove strukture v delih je: skupina bencilo na levi, terciarni amini na sredini in desni - to je skupina za končne nepremičnine.
Reference
- Frančišek a. Želva. Organska kemija. Karboksilne kisline. (Šesta izdaja., Stran 368-397). MC Graw Hill.
- Brennan, John. (10. marec 2018). Primer alkine. Znanstvenik. Vzeto od: Znanstvenik.com
- ByJU's. (2018). Trojna vez v Alkini. Vzet od: Byjus.com
- Enciklopedija primerov (2017). Alkynes. Obnovi se od: Primeri.co
- Kevin a. Boudreaux. Alkynes. Vzeto od: Angelo.Edu
- Robert c. Neuman, jr. Alkeni in Alkynes. [PDF]. Vzet od: kem.Ucr.Edu

