Alkeni
- 4511
- 1071
- Cary Goyette
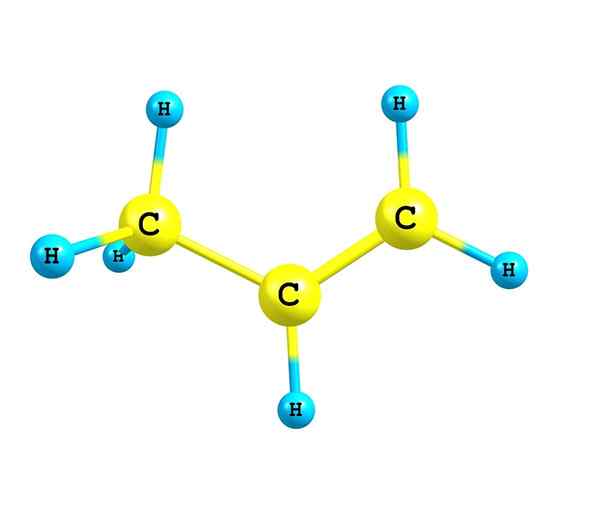
 Alkeni ali olefini so nenasičeni ogljikovodiki, ki imajo v svoji strukturi vsaj dvojno ogljično-ogljikovo vez
Alkeni ali olefini so nenasičeni ogljikovodiki, ki imajo v svoji strukturi vsaj dvojno ogljično-ogljikovo vez Kaj so alkeni?
The Alkeni ali olefini So nenasičeni ogljikovodiki, ki imajo v svoji strukturi vsaj dvojno vez. Imenujejo jih olefini zaradi sposobnosti etena ali etilena, da reagirajo s halogeni, da proizvajajo olje ali olje. Trenutno je izraz Olefinas uporabljen in te spojine se zdaj imenujejo alkeni.
Na fizikalne lastnosti alkenov vplivajo njihova molekulska teža, pa tudi njihovo gazirano okostje. Na primer, alkeni z 2 do 4 ogljikom (buteno etene) so plini. S 5 do 18 ogljikovimi atomi v dolgi verigi so tekoči. Medtem ko so alkeni z več kot 18 ogljikovimi atomi trdni.
Prisotnost dvojne vezi zagotavlja veliko reaktivnost in tako doživlja številne kemijske reakcije, kot so dodatek, izločanje, hidrogenacija, hidracija in polimerizacija, ki omogočajo, da ustvari številne namene in aplikacije.
Alkene proizvajajo industrijsko s toplotnim razpokom visoke molekulske mase (parafinski voski); Katalitična dehidrogenacija in kloriranje-dehidroklinacija.
Kemična struktura alkenov
 Vir: Self Made
Vir: Self Made Za alkene je značilno, da ima v svoji strukturi eno ali več dvojnih povezav. To je predstavljeno kot C = C, saj imata oba ogljikova atoma hibridizacija SP2.
Zato je verižna območje, kjer je dvojna vez ali nenasičenje, ravna. Prav tako je meritor poudariti, da sta oba ogljika lahko povezana z dvema drugima nadomestkoma (ali skupinama).
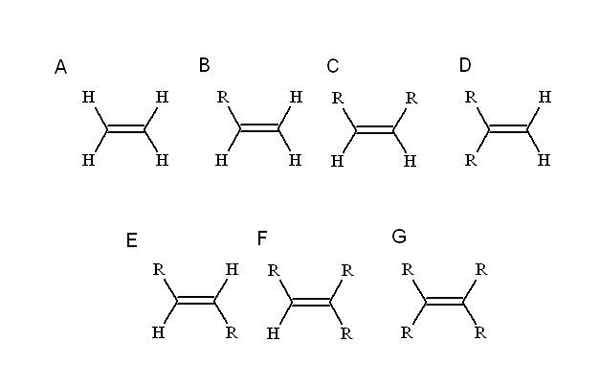
Kateri substituenti? Kdor zamenja enega najpreprostejših alkenskih vodikov: etilen (ali eteno). Začenši od njega (a, nadrejena podoba) R, ki je alkilni substituent, zaseda kraj enega od štirih vodikov, da povzroči mono substitutsko alkene (B).
Zaenkrat, ne glede na to, kateri vodik je nadomeščen, identiteta B ni spremenjena. To pomeni, da mu primanjkuje stereoizomerov, sestavljenih z enakimi kemičnimi formulami, vendar z drugačnim prostorskim razpolaganjem svojih atomov.
Vam lahko služi: točka enakovrednostiStereoizomeri
Ko drugi vodik nadomesti drug R, kot v C, zdaj stereoizomeri C, D in E. To je zato, ker se lahko prostorske usmeritve glede na R lahko razlikujejo in medsebojno opazimo, CIS-Trans ali E-Z se uporabljajo.
V C, di-Substitute Alkene sta lahko dve R veriga poljubne dolžine ali kakšnega heteroátomo. Ena je v čelnem položaju glede na drugo. Če sta na primer oba R enaka substituent, je C stereoisomer-cis.
V D sta obe skupini še bližje, saj sta povezani z istim ogljikovim atomom. To je geminalni stereoizomer, čeprav je več kot stereoizomer, je pravzaprav končna dvojna vez, to je, da je na koncu ali načelo verige (zato ima še dva vodika drugega ogljika).
In v E, najbolj stabilni od stereoizomerov (ali geometrijskih izomerov), sta dve skupini R ločeni z večjo razdaljo, ki prečka diagonalo dvojne vezi. Zakaj je najbolj stabilen? Ker je prostorska ločitev med njima večja, tako ni sestrske napetosti med obema.
Po drugi strani sta F in G alkeni z tri- in tetra. Spet ne morejo ustvariti nobenega stereoizomera.
Fizikalne in kemijske lastnosti alkenov
Topnost
Zaradi nizke polarnosti so neizmerni z vodo. Vendar se raztopijo v organskih topilih.
Fuzijske točke pri ºC
Etano -169, propeno -185, 1 -pentin -165, 1 -hepteno -119, 3 -octein
-101.9, 3 -None -81.4 in 5 -Dechenum -66,3.
Vrelišča v º c
Etano -104, ProPeno -47, Trans2buteno 0,9, Cis2buteno 3,7, 1-penten 30, 1-hepteno 115, 3-OK 122, 3-neneno 147 in 5-Deced.
Vam lahko služi: laboratorijski filter): značilnosti, funkcije, vrsteTočka vrelišča se poveča v neposredni povezavi s številom alkenskih ogljikov. Po drugi strani pa bolj razvejana njegova struktura, najšibkejše so njene medmolekularne interakcije, ki se odražajo v zmanjšanju vrelišča ali fuzijske točke.
Gostota
Etano 0,6128 mg/ml, propeno 0,6142 mg/ml in 1-buten 0,6356 mg/ml, 1-petej 0,64 mg/ml in 1-heksen 0,673.
V alkenih je največja gostota 0,80 mg/ml. To pomeni, da so manj goste kot voda.
Polarnost
Odvisno je od kemijske strukture, substitucij in prisotnosti drugih funkcionalnih skupin. Alkeni imajo dipmere, torej 2-butenski cis izomer.
Reaktivnost alkenov
Alkeni imajo veliko sposobnost reagiranja zaradi dvojnih povezav, ki jih imajo. Med vključenimi reakcijami so: dodatek, izločanje, zamenjava, hidrogenacija, hidracija in polimerizacija.
Dodatna reakcija
H2C = pogl2 + Cl2 => CLCH2-CCLH2 (etilen diklorid)
Reakcija hidrogenacije
Pojavi se pri visokih temperaturah in v prisotnosti ustreznih katalizatorjev (PT, PD ali fino razdeljen)
Pogl2= Pogl2 + H2 => Ch3-Pogl3 (Etano)
Hidracijska reakcija
Reakcija, ki je vir nastajanja alkohola iz derivatov nafte:
H2C = pogl2 + H2O => h3C-ch2Oh (etilni alkohol)
Reakcije polimerizacije
Etilen v prisotnosti katalizatorjev, kot sta aluminijev preskus in titanov tetrakloridni polimeriza v polietilenu, ki vsebuje približno 800 ogljikovih atomov. Ta vrsta polimera se imenuje dodatni polimer.
Uporaba in aplikacije alkenov
Polimeri
- Polietilen z nizko gostoto se uporablja pri izdelavi vrečk, toplogrednih plastike, embalaže, jedi, posod itd. Medtem ko je visoka gostota bolj toga in mehansko odporna, pri čemer uporablja pri izdelavi škatel, pohištva, zaščitnikov, kot so čelade in kolena, igrače in palete.
- Polipropilen, propilen polimer, se uporablja pri izdelavi zabojnikov, listov, laboratorijske opreme, igrač, embalažnih filmov, sogas, oblazinjenje in preproge.
- Polivinil klorid (PVC) je polimer vinil klorida, ki se uporablja pri izdelavi cevi, ploščic za tla, kanale, vrata in okvir za Windows itd.
- Polibutadien, polimer 1,3-butadiena, je namenjen proizvodnji ležajnih pasov, cevi in pasovih vozil, pa tudi za prevleko kovinskih pločevink.
- Kopolimeri etilena in propilen se uporabljajo pri proizvodnji cevi, telesa in delov podvozja za tekstil itd.
Alkeni
- Uporabljajo se pri pridobivanju topil, kot sta etilen glikol in dioksan. Etilen glikol se uporablja kot antifriz v avtomobilskih radiatorjih.
- Etilen je hormon rastlin, ki nadzoruje njegovo rast, kalitev semen in razvoj sadja. Zato se uporablja za induciranje zorenja banan, ko pridejo do cilja.
- Uporabljajo se kot surovina za proizvodnjo številnih spojin, kot so alkil halogenidi, etilen oksid in zlasti etanol. Uporabljajo se tudi v industriji, osebni negi in medicini.
- Uporabljajo se pri pridobivanju in izdelavi lakov, detergentov, aldehidov in goriv. 1.3-butadieno se uporablja kot surovina pri proizvodnji sintetičnih gumarjev.
Reference
- Naloga kemije. Fizikalne lastnosti alkenov. Vzet iz: dodelitev kemije.com
- Wikipedija. (2018). Alkene. Vzeto od: v.Wikipedija.org
- Kemija librettexts. Fizikalne lastnosti alkenov. Vzet od: kem.Librettexts.org
- Whitten, Davis, Peck & Stanley. Kemija. (8. izd.). Cengage učenje.
- Frančišek a. Želva. Organska kemija. (Šesta izdaja., Stran 194). MC Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkeni: molekularne in strukturne formule. Vzeto iz: CliffsNotes.com
- Chipera, Angie. (25. april 2017). Kaj je olefin v kemiji? Znanstvenik. Vzeto od: Znanstvenik.com

