Alosterizem Splošni vidiki, funkcije in primeri

- 1166
- 350
- Percy Feeney
On Alosterizem O alostrična regulacija je opredeljena kot proces inhibicije ali aktiviranja encima, ki ga posreduje regulativna molekula, ki se razlikuje od njegove podlage in deluje na določenem mestu njene strukture, ki se razlikuje od aktivnega mesta istega mesta.
Izraz "alosteric" ali "alosterizem" izvira iz grških korenin "alos ", kar pomeni "drugo" in "Stereós", kar pomeni "oblika" ali "kraj"; Tako dobesedno prevaja kot "drugi prostor", "drug kraj" ali "drugo strukturo".
 Grafična shema teosterične regulacije. (A) Aktivno spletno mesto. (B) Alosterično mesto. (C) podlaga. (D) zaviralec. (E) encim. (Vir: Isaac Webb [CC BY-S (https: // createCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons)
Grafična shema teosterične regulacije. (A) Aktivno spletno mesto. (B) Alosterično mesto. (C) podlaga. (D) zaviralec. (E) encim. (Vir: Isaac Webb [CC BY-S (https: // createCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons) Nekateri avtorji opisujejo alosterizem kot proces, s katerim so oddaljena mesta v sistemu (struktura encima, na primer), energično povezana, da ustvarijo funkcionalni odziv, zato je mogoče domnevati, da lahko sprememba v regiji vpliva na katero koli drugo regijo v istem.
Ta vrsta regulacije je značilna za encime, ki sodelujejo v več znanih bioloških procesih, kot so transdukcija signala, metabolizem (anabolizem in katabolizem), regulacija genetske ekspresije.
Prve ideje o alosterizmu in njihovi udeležbi pri nadzoru celičnega metabolizma so v šestdesetih letih postavili F. Monod, f. Jacob in J. Menjava, medtem ko je preučevala biosintetske poti različnih aminokislin, ki so bile zavirane po kopičenju končnih produktov.
Čeprav je bila prva publikacija v zvezi s tem povezana z genetsko regulacijo, so kratek čas pozneje Monod, Wyman in Changeux razširili pojmovanje alosterizma na beljakovine z encimsko aktivnostjo in predlagali model, ki temelji na multimernih beljakovinah od teh se je pridružil efektorju.
Vam lahko služi: Guanina: značilnosti, struktura, usposabljanje in funkcijeŠtevilni naslednji koncepti so imeli osnovo v teoriji "inducirane prilagoditve", ki jo je Koshland uvedel nekaj let prej.
[TOC]
Splošne lastnosti
Na splošno imajo vsi encimi dve različni mesti za ligand Union: eno je znano kot aktivno mesto, ki se pridruži molekulam, ki delujejo kot substrat (odgovorni za biološko aktivnost encima) spletno mesto, ki je značilno za druge presnovke.
Ti "drugi presnovki" se imenujejo alestherični efektorji in lahko pozitivno ali negativno vplivajo na hitrost reakcij, ki jih katalizirajo encimi, ali na afiniteto, s katero se pridružijo svojim podlagam na aktivnem mestu.
Običajno združitev efektorja na AL, encimsko mesto povzroči vpliv na drugo mesto strukture, ki spreminja njegovo aktivnost ali funkcionalno delovanje.
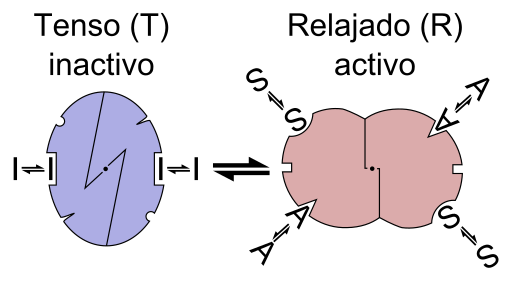 Grafična shema reakcije encima alosterica (vir: datoteka: encim alostery je.PNG: Datoteka: encim alostery.PNG: Alostery.PNG: Nicolas le Novere (pogovor).Lenov v.Wikipediaderivacijsko delo: Timvickers (pogovor) Derivacijski delo: Retama (pogovor) Derivacijsko delo: KES47 [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons)
Grafična shema reakcije encima alosterica (vir: datoteka: encim alostery je.PNG: Datoteka: encim alostery.PNG: Alostery.PNG: Nicolas le Novere (pogovor).Lenov v.Wikipediaderivacijsko delo: Timvickers (pogovor) Derivacijski delo: Retama (pogovor) Derivacijsko delo: KES47 [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons) Z drugimi besedami, združitev alestro efektorja do njenega specifičnega mesta v strukturi encima povzroči spremembo molekularne geometrije encima, ki je znana kot prehod na Teosteric, to je dogodek, ki se prenaša V celotni makromolekuli spreminjajo njegovo vedenje.
Alosterizem je lahko homotropni ali heterotropni. Homotropni postopek alostroične regulacije je opredeljen kot tisti, v katerem isti substrat encima deluje kot njen alestrični regulator, to je, da je alosterični efektor isti substrat; Znana je tudi kot vrsta zadruge.
Po drugi strani se postopek heterotropne regulacije nanaša na regulacijo aktivnosti encima, ki ga posreduje molekula ali efektor Teosteric, ki se razlikuje od njegovega substrata, in lahko tudi pozitivno ali negativno vpliva na aktivnost encima.
Lahko vam služi: Aptenia cordifolia: značilnosti, habitat, lastnosti, gojenjeFunkcije
Alosterizem, skupaj z regulacijo genetske ekspresije, prevajanja in razgradnje beljakovin, je eden temeljnih mehanizmov za regulacijo velikega števila organskih procesov, ki je bistvenega bitja.
Toostalna regulacija ali alosterizem daje živemu organizmom sposobnost, da se odzivajo z veliko občutljivostjo na spremembe koncentracije regulativnih ligandov, pa tudi pri izvoru ritmičnih pojavov na celični ravni.
Ker sta energija in presnovni substrati v celici končna, alosterizem na presnovnem področju omogoča zmerno uporabo virov, izogibanje neuporabnim ciklom in odpadkom energije za prekomerno obdelavo substratov v pogojih številčnosti ali pomanjkanja.
Podobno je ta regulacijski mehanizem zelo pomemben za procese signalizacije celic, v katerih so vključene številne konformacijske spremembe, ki jih sproži zveza različnih ligandov na določenih mestih zadevnih receptorjev.
Primeri alosterizma
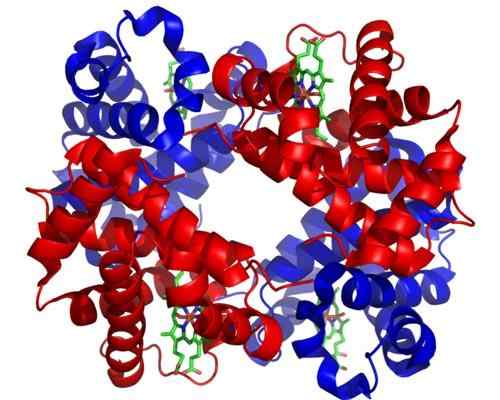 Hemoglobin. Vzeto in urejeno od: Zephyris na angleškem jeziku Wikipedia [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]].
Hemoglobin. Vzeto in urejeno od: Zephyris na angleškem jeziku Wikipedia [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Čeprav je v naravi na tisoče primerov noosterizma ali ureditve, so bili nekateri vidnejši od drugih. Takšen je primer hemoglobina, ki je bil eden prvih beljakovin, opisanih v globini v strukturnem vidiku.
Hemoglobin je za številne živali zelo pomemben protein, saj je odgovoren za transport kisika skozi kri iz pljuč do tkiv. Ta protein hkrati predstavlja homotropno in heterotropno do teosterične regulacije.
Vam lahko služi: salacionizem: značilnosti, dokazi in primeriHomotropni alosterizem hemoglobina je povezan z združenjem molekule kisika na eno od podenot, ki jo sestavljajo neposredno, vpliva na afiniteto, s katero je podenota, ki meji na drugo molekulo kisika.
Heterotropni na heterotropni
Heterotropni alosterizem je na drugi strani povezan z učinki pH in prisotnosti 2,3-difglicerata na zvezo kisika na podenote tega encima in ga zavira.
TransCarbamilaza ali Atcasa Aspartate, ki sodeluje na poti sinteze pirimidina, je tudi eden od "klasičnih" primerov alosterične regulacije. Ta encim, ki ima 12 podenot, od katerih je 6 katalitično aktivnih, 6.
Laktozni operon In. coli
Plod prvih idej Monoda, Jacoba in Changeauxa je bil članek, ki sta ga objavila Jacob in Monod, povezana z laktozo laktoze laktoze Escherichia coliYo, ki je eden od tipičnih primerov regulacije heterotropne in genske ravni.
Toostalna regulacija tega sistema ni povezana s sposobnostjo pretvorbe podlage v izdelek, temveč z afiniteto združevanja beljakovin v operativno območje DNK.
Reference
- Changeux, J. Str., & Edelstein, s. J. (2005). Alosterični mehanizmi transdukcije signala. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Alosterična regulacija, skupna in biokemična nihanja. Biofizična kemija, 37 (1-3), 341-353.
- Jiao, w., & Parker in. J. (2012). Uporaba kompinacije računskih in eksperimentalnih tehnik za razumevanje molekulske podlage za alosteriranje beljakovin. V napredku beljakovinske kemije in strukturne biologije (Vol. 87, str. 391-413). Akademski tisk.
- Kern, d., & Zuiderweg in. R. (2003). Vloga dinamike pri alosterični regulaciji. Trenutno mnenje v strukturni biologiji, 13 (6), 748–757.
- Laskowski, r. Do., Gerick, f., & Thornton, J. M. (2009). Strukturna osnova alosterične regulacije v beljakovinah. FEBS Letters, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, k. In., & Ahern, k. G. (2000). Biokemija, ed. San Francisco, Kalif.
- « Struktura ogljikovih nanocevk, lastnosti, aplikacije, toksičnost
- Prilagodljivi proces sevanja, vrste in primeri »

