Alilo Alilic Unit, karbokacija, radikalna, primeri

- 785
- 163
- Cary Goyette
On Alilo ali 2-zapora je organska skupina ali substituent, katere strukturna formula je CHO2= Ch-ch2-. Je sestavljen iz vinilnega fragmenta, ch2= Ch-, in metilenska skupina, -ch2-. Sestavljen je iz alkenilne skupine, posebej izhaja iz propena, Cho2= Ch-ch3.
Izraz "Alilo" je posledica botaničnega imena, ki se uporablja za česen: Allium sativum, katerih olja leta 1892 so bila izolirana sestavljeni dialfid, h2C = chch2Ssch2Ch = ch2, odgovoren v delu svojih značilnih vonjav. Pravzaprav veliko aliličnih spojin, torej tistih, ki imajo skupino Alilo, najdemo v česnu in zelenjavi.
 Skupina Alilo
Skupina Alilo Zgornja slika prikazuje skeletno formulo skupine Alilo. Poleg sinuonosti na desni imamo preostanek molekule; Če je to Alquilica, bo predstavljen s simbolom R.
Alilo je enostavno prepoznati, ker je zelo podoben vinilni skupini. Vendar je Alilo lahko tudi cikličen, neopažen v spojinah, kot so ciklopi.
Primer alilske spojine je zavezniški alkohol, h2C = chch2Oh. Hidogene vinilnega fragmenta lahko zamenjate in ostanejo alilo. Tako 3-metil-2-bunt-1-ol, (CHO3)2C = chch2Oh, to je tudi ali ali. Zato je možen obstoj cikličnih alilos.
[TOC]
ALLICIČNA ENOTA IN NJEGOVI DELI
Pomembnejša od skupine Alilo, je ali je za vse spojine ALLIC to enaka enota. To je: C = C-C. Konec C = C ustreza vinilnim ogljikom. Vsi atomi, povezani s tema dvema ogljikovoma, bodo prejeli tudi ime vinilnih substituentov. Na primer, če so vodiki, CHO2= Ch, govorimo o vinilnih vodikih.
Medtem na drugi strani ekstremna -C ustreza ALLIC ogljiku. Vsi atomi ali skupine, povezane s tem ogljikom. Zato so aluične spojine natančno vsi tisti, ki imajo funkcionalno skupino (OH, S, F, COOH itd.) Allyic Ogljik.
Vam lahko služi: natrijev citrat (C6H5O7NA3): struktura, uporabe, lastnostiVinilni ogljiki imajo hibridizacijo SP2, Torej so bolj elektronegativni kot ali alilični ogljik, Spo3. Ta razlika v elektronegativnosti povečuje kislost ali aliličnih hidrogenov, pri čemer je tvorba ali. Toda bolj donosno v smislu organske sinteze, je to alilska karbokacija, ki bo razložena spodaj.
Karbokacija
Resonančne strukture
 Alilične resonančne strukture karbokacije. Vir: razpustitev/cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0
Alilične resonančne strukture karbokacije. Vir: razpustitev/cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0 Na zgornji sliki je prikazana karbokacija Ally. Upoštevajte, da se pozitivna obremenitev (+) najprej pojavi na Allic Carbonu. Vendar pa bodo takoj pritegnili elektrone z dvojnim vezanjem, zato se bodo premikali v smeri atoma ali atoma ali.
Posledično imamo dve resonančni strukturi (levo od slike). Zdaj se pozitivna obremenitev nahaja na enem od vinilnih ogljikov. Ponovno bo elektrone dvojne vezi ALLIC -a spet pritegnilo pozitivno obremenitev in se vrnili v svoj začetni položaj. To se ponavlja znova in znova, z nepredstavljivimi hitrostmi.
Rezultat: Pozitivna obremenitev +1 se preseli ali razprši med tremi atomi enote ALLIC; Toda osredotočiti se le na dva ogljika koncev. Tako eden od vinilnih ogljikov ohrani obremenitev 1/2 +, medtem ko Allyl Carbon ostane z drugo polovico obremenitve in dodaja +1.
Primernejši način za predstavljanje aluične karbokacije je s svojim resonančnim hibridom (desno od slike). Tako opazimo, da se pozitivna obremenitev porazdeli po enoti Allic.
Lahko vam služi: aluminijev klorid (ALCL3)Stabilnost in porazdelitev pozitivne obremenitve
Demokacija pozitivne obremenitve daje stabilnost aluična karbokacija. Toliko je, da se izenačuje s sekundarno karbokacijo v smislu stabilnosti.
Na sliki, ker gre samo za Alllic enota, se domneva, da je porazdelitev pozitivne obremenitve enakovredna obema ogljikoma (+1/2 za vsakega). Toda to ni izpolnjeno za vse spojine. Tako bo več ali manj pozitivnih karbokacij; kar pomeni, da bodo bolj ali manj reaktivni.
Razmislite na primer alilo kation:
H2C = ch-ch2+ ↔ h2C+-Ch = ch2
Dve resonančni strukturi sta enakovredni z distribucijo pozitivne obremenitve. Vendar se ne zgodi enako, s kationom 1.1-dimetilil:
H2C = ch-c+(Pogl3)2 ↔ h2C+-Ch = c (ch3)2
V strukturi levice je pozitivna obremenitev bolj stabilizirana s prisotnostjo obeh metilnih skupin, ki darujejo del njihove negativne gostote ogljika.
Medtem vinilni hidrogeni ne prispevajo ničesar k pozitivni obremenitvi na vinilnem ogljiku. Zato bo struktura levice bolj prispevala k resonančnemu hibridu tega aliznega kationa.
Ključnega pomena je, da upoštevamo, da so resonančni hibridi najbližji resničnemu stanju teh karbokacij in ne njihovih struktur ločeno.
Radikalno
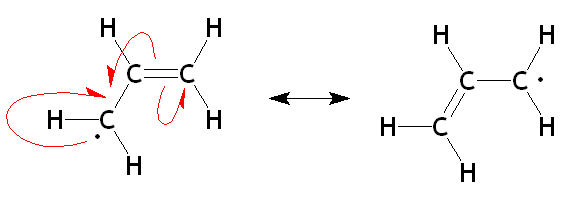 Alilo radikalne resonančne strukture. Vir: Organaute/CC by-SA (https: // createCommons.Org/licence/by-sa/3.0
Alilo radikalne resonančne strukture. Vir: Organaute/CC by-SA (https: // createCommons.Org/licence/by-sa/3.0 Na zgornji sliki sta zdaj prikazani dve resonančni strukturi aluičnega radikala v ustrezni alilični enoti. Upoštevajte, da je narava njegovega razvoja enaka kot karbokacija: izginotni elektron (·) je demokaliziran med obema ogljikoma koncev. Zato bo vsak imel "elektronski medij" (1/2 ·).
Vam lahko služi: kation: trening, razlike z anionom in primeriKar je razloženo za karbokacijo in radikalno alilično.
Primeri aliličnih spojin
Omenili bodo, da bodo zaključili več primerov aliličnih spojin. V vsakem od njih bo prisotna enota Allic:
-Alilo klorid, h2C = ch-ch2-Cl
-Allyic metil sulfid, h2C = ch-ch2-S-ch3 (Druge spojine, odgovorne za vonj česna)
-Alicina, h2C = ch-ch2-S (o) -s -ch2-Ch = ch2
-Krotilni alkohol, cho3Ch = ch --ch2Oh (upoštevajte, da enega od vinilnih vodikov nadomesti z metilom)
-Alilo acetat, h2C = ch-ch2-Oc (o) ch3
-Alilo bromide, h2C = ch-ch2-Br
-Alilamina, h2C = ch-ch2-Nh2 (Osnovna enota za bolj zapletene alilamine, ki se uporabljajo kot antifunkicidi)
-Dimetilalilni pirofosfat, (ch3)2C = ch-ch2-OPO2-O-po3
V naslednjem paru alilaminov, flunarizinu in naftifinu, oba s farmakološkimi učinki, lahko cenimo skupino Alilo:
 Strukturne formule dveh alilaminov. Vir: HBF878 / CC0.
Strukturne formule dveh alilaminov. Vir: HBF878 / CC0. V obeh je na desni: ta dvojna vez, vložena med piperazinskimi obroči (šesterokotni z dvema atoma dušika) in benzenom. Upoštevajte, da je za prepoznavanje Alila bistvenega pomena.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). ALLIL SKUPINA. Pridobljeno iz: v.Wikipedija.org
- Elsevier b.V. (2020). Alil spojina. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Gamini Gunawardena. (5. junij 2019). Alilski ogljik. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Značilnosti zgodovinskih stroškov, prednosti, slabosti, primeri
- Koncept, funkcije, primeri navzkrižnih referenc »

