Značilnosti, struktura, funkcije Alfa amilasa
- 4356
- 924
- Cary Goyette
The Alfa Amilasa (α-amilaza) je amilolitski encim skupine endo amilasas, ki je odgovoren za hidrolizo α-1,4 vezi med ostanki glukoze, ki sestavljajo različne vrste ogljikovih hidratov v naravi.
Sistematično znan kot sistematično znan kot α-1,4-glukan. Pri ljudeh so na primer amilaze, prisotne v slini, in tiste, ki jih izloča trebušna slinavka.
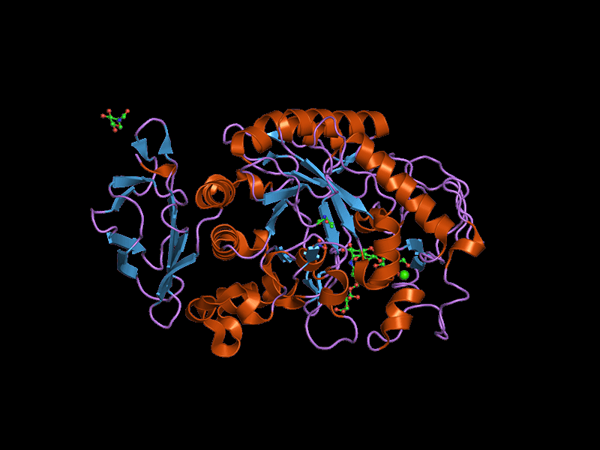
 C-terminalna domenska struktura živali Alfa Amilasa (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons)
C-terminalna domenska struktura živali Alfa Amilasa (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons) Kuhn je bil leta 1925 prvi, ki je kovanca, ki je koval izraz "α-amilaza", na podlagi dejstva, da so produkti hidrolize, ki katalizirajo te encime, konfiguracijo α. Kasneje, leta 1968.
Tako kot drugi amilolitski encimi je tudi α-amilaza odgovorna za hidrolizo škroba in drugih povezanih molekul, kot je glikogen, ki proizvaja manjše polimere, sestavljene iz ponavljajočih se enot glukoze.
Poleg fizioloških funkcij, ki jih ima ta encim pri živalih, rastlinah in mikroorganizmih, ki jo izražajo, α-amilazo, skupaj z drugimi razredi obstoječih amilaz, predstavljajo 25% encimov, ki se uporabljajo za industrijske in biotehnološke namene trenutnega trga.
Številne vrste gliv in bakterij so glavni vir pridobivanja α-amilaz, ki se pogosteje uporabljajo v industriji in znanstvenem eksperimentiranju. To je predvsem posledica vsestranskosti, enostavnega pridobivanja, preprostega upravljanja in nizkih stroškov, povezanih s svojo proizvodnjo.
[TOC]
Značilnosti
Α-amilaze, ki jih najdemo v naravi, imajo lahko za njegovo delovanje optimalno območje pH zelo drugačnega pH; Na primer, optimalen za živali α-amilaze in rastlina je med 5.5 in 8.0 pH enot, vendar imajo nekatere bakterije in glive več alkalnih encimov in več kislin.
Vam lahko služi: filogenijaEncimi, ki so prisotni v slini in trebušni slinavki, delujejo bolje pri pH blizu 7 (nevtralno). Poleg tega potrebujejo kloridne ione, da dosežejo svojo največjo encimsko aktivnost in se lahko pridružijo dvovalentnim kalcijevim ionom.
Encimi za živali, slinavke in trebušne slinavke se v organizmih proizvajajo z neodvisnimi mehanizmi, ki vključujejo specifične celice in žleze in verjetno niso povezani z encimi, ki so prisotni v obtočnih hudournikih in drugih telesnih votlinah.
Tako pH kot optimalna temperatura za delovanje teh encimov je močno odvisna od fiziologije organizma, ki se upošteva, saj obstajajo ekstremni mikroorganizmi, ki v zelo posebnih pogojih rastejo v zvezi s temi in številnimi drugimi parametri.
Nazadnje je glede na regulacijo svoje aktivnosti značilno, da se med encimi skupine α-amilaze ta, tako kot druge amilaze.
Struktura
Α-amilaza je multidominijev encim, ki ima pri živalih in rastlinah približno molekulsko maso 50 kDa, različni avtorji.
Osrednja domena ali katalitična domena je zelo ohranjena in je znana kot domena A, ki je sestavljena iz simetrične pregibe 8 β-nameščenih listov, razporejenih v obliki "soda", ki jih obkroža 8 alfa dvoran V literaturi, kako (β/α) 8 ali "tim" tipa sod.
Pomembno je opozoriti, da so na C-terminalnem koncu β listov domene A ohranjeni aminokislinski odpadki, ki sodelujejo v katalizi in v stičišču substrata in da se ta domena nahaja v območju N-terminala beljakovine.
Lahko vam služi: favna in flora perujskega morjaDruga izmed najbolj preučenih domen teh encimov je tako imenovani Ding B, ki izstopa med β-poskočno lamino in alfa številka 3 propelerja domene A. To ima temeljno vlogo v zvezi s substratom in dvovalentnim kalcijam.
Za encime α-amilasa so bile opisane dodatne domene, kot so domene C, D, F, G, H in I, ki se nahajajo spredaj ali zadaj domene A in katerih funkcije niso natančno in odvisne od organizma, ki je organizem, ki preučuje se.
α-amilaze mikroorganizmov
Molekularna masa α-amilaze je odvisna od drugih biokemičnih in strukturnih značilnosti na organizmu, ki ga preučujemo. Tako imajo α-amilaze številnih gliv in bakterij uteži do 10 kDa in do 210 kDa.
Visoka molekulska masa nekaterih teh mikrobnih encimov je pogosto povezana s prisotnostjo glikozilacije, čeprav je glikozilacija beljakovin pri bakterijah precej redka.
Funkcije
Pri živalih so α-amilaze odgovorne za prve korake v presnovi škroba in glikogena, saj so odgovorni za svojo hidrolizo do manjših fragmentov. Organi prebavnega sistema, ki so zadolženi za njihovo proizvodnjo pri sesalcih.
Poleg očitne presnovne funkcije proizvodnja α-amilaz, ki jih proizvajajo slinavine žleze številnih sesalcev, ki jih aktivira norepinefrinsko delovanje, mnogi avtorji obravnavajo kot pomemben "psihobiološki" označevalec stresa v stresu v centralnem živčnem sistemu v centralnem živčnem sistemu.
Ima tudi sekundarne funkcije v oralnem zdravju, saj njegova aktivnost deluje pri izločanju peroralnih bakterij in pri preprečevanju njenega oprijema na oralne površine.
Lahko vam služi: simpatična specifikacija: koncept, značilnosti in primeriGlavna funkcija v rastlinah
V rastlinah imajo α-amilaze glavno vlogo pri kalitvi semen, saj gre za encime, ki hidrolizirajo škrob, ki je prisoten v endospermu, ki neguje zarodek v notranjosti, proces, ki ga v bistvu nadzoruje Gibberelin, fitormon.
Industrijske aplikacije
Encimi, ki pripadajo družini α-amilaz, imajo več aplikacij v različnih okoliščinah: industrijske, znanstvene in biotehnološke itd.
V velikih predelovalnih panogah škroba se α-amilaze popularno uporabljajo za proizvodnjo glukoze in fruktoze, pa tudi za proizvodnjo kruha z izboljšanimi teksturami in z večjo zvesto zmogljivostjo.
Na biotehnološkem področju obstaja veliko zanimanja glede izboljšanja encimov, ki se komercialno uporabljajo, da bi izboljšali njihovo stabilnost in uspešnost v različnih pogojih.
Reference
- Aiyer, str. V. (2005). Amilaze in njihove aplikacije. Afriški časopis za biotehnologijo, 4(13), 1525-1529.
- Bernfeld, str. (1960). Amilaze, a in b. V Encimi presnove ogljikovih hidratov (Vol. Jaz, str. 149-158).
- Granger, d. Do., Kivighan, k. T., Njim., Gordis, e. B., & Stud, l. R. (2007). Slinavska a-andlaza v biobehavioralnih raziskavah. Nedavni razvoj in aplikacije. Ann. N.In. Acade. Sci., 1098, 122-144.
- Monteiro, str., & Oliveira, str. (2010). Uporaba mikrobne andlaze v industriji- pregled. Brazilski časopis za mikrobiologijo, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, k. R. S. S. (2003). Pregled družine mikrobnih α-Love. Afriški časopis za biotehnologijo, 2(12), 645–648.
- Sol, w., & Shenker, s. (1976). Amilaza- njegov klinični pomen: pregled literature. Zdravilo, 55(4), 269-289.
- Svensson, b., & MacGregor in. Do. (2001). Razmerje zaporedja in strukture do specifičnosti v družini encimov A-amilaze. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. Do., Spradlin, J. In., & Dygert, s. (1925). Rastlinske in živalske amilaze. Ann. Kem., 1, 115-189.
- « Reninova struktura, proizvodnja, izločanje, funkcije
- URIE Bronfenbrennerjeva biografija, ekološki model in prispevki »

