Sredstvo za zmanjšanje koncepta, najmočnejši primeri

- 4411
- 869
- Miguel Gutmann DVM
A zmanjšanje sredstva To je snov, ki izpolnjuje funkcijo zmanjšanja oksidacijskega sredstva v reakciji oksida-redukcije. Zmanjšajoča sredstva so po naravi darovalci elektronov, običajno snovi, ki so na njihovi najnižji ravni oksidacije in z veliko količino elektronov.
Obstaja kemična reakcija, pri kateri se oksidacijska stanja atomov razlikujejo. Te reakcije vključujejo komplementarni postopek zmanjšanja in oksidacije. V teh reakcijah se eden ali več elektronov ene molekule, atoma ali iona prenese na drugo molekulo, atom ali ion. To pomeni proizvodnjo reakcije redukcije oksida.

Med postopkom redukcije oksida se ta element ali spojina, ki izgubi (ali doni) njegov elektron (ali elektroni), imenuje reducirajoče sredstvo, v nasprotju s tistim oksidacijskim sredstvom, ki je elektronski receptor. Nato se reče, da reducirska sredstva zmanjšajo oksidacijsko sredstvo in da oksidacijsko sredstvo oksidira reducirajoče sredstvo.
Najboljša ali najmočnejša sredstva za zmanjšanje so tisti, ki imajo največji atomski radio; to pomeni, da imajo večjo razdaljo od svojega jedra do elektronov, ki obkrožajo isto.
Reducirska sredstva so običajno kovinski ali negativni ioni. Med pogostimi reducirajočimi sredstvi so askorbinska kislina, žveplo, vodik, železo, litij, magnezij, mangan, kalij, natrij, vitamin C, cink in celo korenčkov ekstrakt.
[TOC]
Kaj so sredstva za zmanjšanje?
Kot že rečeno, so reducirajoča sredstva odgovorna za zmanjšanje oksidacijskega sredstva, ko pride do reakcije oksida-redukcije.
Preprosta in značilna reakcija reakcije oksida-redukcije je reakcija aerobnega celičnega dihanja:
Vam lahko služi: aluminijski hidrid (ALH3): struktura, lastnosti, uporabeC6H12Tudi6(s) + 6o2(g) → 6co2(g) + 6h2Ali (l)
V tem primeru, kjer glukoza (c6H12Tudi6) reagira s kisikom (ali2), glukoza se obnaša kot reducirajoče sredstvo, da daje elektrone kisiku - to pomeni, da se oksidira - in kisik postane oksidacijsko sredstvo.
V organski kemiji se najbolj reducirajoča sredstva štejejo za reagente, ki zagotavljajo vodik (H2) do reakcije. Na tem področju kemije se reakcija redukcije nanaša na dodajanje vodika v molekulo, čeprav velja tudi prejšnja definicija (reakcije oksida-redukcije tudi.
Dejavniki, ki določajo silo reducirajočega sredstva
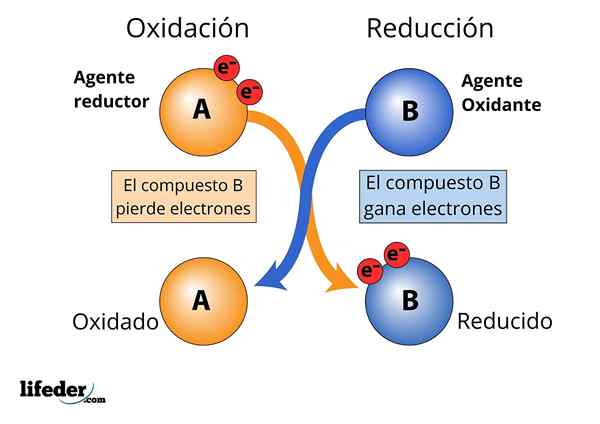 Oksidiranje in zmanjšanje sredstva, izgube in dobiček elektronov
Oksidiranje in zmanjšanje sredstva, izgube in dobiček elektronov Da se snov šteje za "močno".
Za to je treba upoštevati številne dejavnike, da prepoznamo silo, ki jo ima lahko reducirajoče sredstvo: elektronegativnost, atomski polmer, ionizacijska energija in potencial redukcije.
Elektronegativnost
Elektronegativnost je last, ki opisuje težnjo atoma privabljanja nekaj elektronov, združenih proti sebi. Višja kot je elektronegativnost, večja je sila privlačnosti, ki jo atom izvaja okoli okoliških elektronov.
V periodični tabeli se elektronegativnost poveča z leve na desno, zato so alkalne kovine najmanj elektronegativni elementi.
Atomski radio
Lastnost meri količino atomov. Nanaša se na tipično ali povprečno razdaljo središča atomskega jedra do meje elektronskega oblaka, ki ga obdaja.
Vam lahko služi: nitrite: lastnosti, struktura, nomenklatura, tvorbaTa lastnost ni natančna - in poleg tega je v njegovo opredelitev vključenih več elektromagnetnih sil - vendar je znano, da se ta vrednost zmanjšuje od leve proti desni v periodični tabeli in se povečuje od vrha do dna. Zato alkalne kovine, zlasti cezij, veljajo za večji atomski radio.
Ionizacijska energija
Ta lastnost je opredeljena kot energija, potrebna za odstranitev manj združenega elektrona iz atoma (Valencia Elecn), da tvori kation.
Govori se, da ko so elektroni bližje jedru atoma, ki obdaja, večja je ionizacijska energija atoma.
Ionizacijska energija se poveča z leve desne in od spodaj navzgor v periodični tabeli. Spet imajo kovine (zlasti alkalne) manj ionizacijske energije.
Potencial redukcije
Je merilo nagnjenosti k kemičnim vrstam, da dobijo elektrone in se zato zmanjšajo. Vsaka vrsta ima lastni potencial za zmanjšanje: večji kot je, večja je afiniteta z elektroni in tudi njegova sposobnost zmanjšanja.
Zmanjšajoča sredstva so tiste snovi z manjšim potencialom zmanjšanja zaradi svoje majhne afinitete z elektroni.
Močnejša sredstva za zmanjšanje
Z zgoraj opisanimi dejavniki je mogoče sklepati, da je zaželeno najti "močno" reducirajoče sredstvo, atom ali molekulo z nizko elektronegativnostjo, visokim atomskim polmerom in nizko ionizacijsko energijo.
Kot smo že omenili, alkalne kovine predstavljajo te značilnosti in veljajo za najmočnejša sredstva za redukcije.
Vam lahko služi: alifatski ogljikovodiki: lastnosti, nomenklatura, reakcije, vrstePo drugi strani se litij (LI) šteje za najmočnejše zmanjševalno sredstvo za najnižji potencial zmanjšanja, medtem ko je molekula Lialh4 Velja za najmočnejšega zmanjšanja od vseh, saj vsebuje to in druge želene značilnosti.
Primeri reakcij z reducirajočimi sredstvi
V vsakdanjem življenju je veliko primerov zmanjšanja oksida. Spodaj je nekaj najbolj reprezentativnih:
Primer 1
Reakcija zgorevanja oktana (glavna sestavina bencina):
2 c8H18(l) + 25o2 → 16Co2(g) + 18h2O (g)
Lahko vidite, kako oktane (reducirajoče sredstvo) dona kisikove elektrone (oksidacijsko sredstvo), ki v velikih količinah tvorijo ogljikov dioksid in vodo.
Primer 2
Glukozna hidroliza je še en uporaben primer skupnega zmanjšanja:
C6H12Tudi6 + 2adp + 2p + 2nad+ → 2ch3Kokosov oreh2H + 2ATP + 2nadh
V tej reakciji molekule NAD (elektronski receptor in oksidacijsko sredstvo v tej reakciji) jemljejo glukozne elektrone (reducirsko sredstvo).
Primer 3
Končno v reakciji železovega oksida
Vera2Tudi3(s) + 2al (s) →2Tudi3(s) + 2fe (l)
Redsko sredstvo je aluminij, medtem ko je oksidacijsko sredstvo železo.
Reference
- Wikipedija. (s.F.). Wikipedija. Pridobljeno iz in.Wikipedija.org
- BBC. (s.F.). BBC.co.Združeno kraljestvo. Pridobljeno iz BBC.co.Združeno kraljestvo
- Pearson, d. (s.F.). Kemija librettexts. Pridobljeno iz kem.Librettexts.org
- Raziskave, b. (s.F.). BODNER RAZISKOVALNI SEB. Pridobljeno iz Murmeda.Kem.Purdue.Edu
- Peter Atkins, L. J. (2012). Kemična načela: iskanje vpogleda.
- « Lastnosti Cassia angustifolia, priprave, kontraindikacije
- Značilnosti azimutalne projekcije, vrste, prednosti, slabosti »

