Kalijev yodato (kio3)
- 1478
- 165
- Barry Ernser
Kaj je kalijev jodat?
Kalijev ali kalijev Yodato Yodato je anorganska jodna spojina, zlasti sol, katere kemična formula je kio3. Jod ali jod, element halogenske skupine (f, cl, br, i, as), ima v tej soli oksidacijsko število +5; Zato gre za močno oksidacijsko sredstvo. Kio3 V vodnem mediju disociira, da ustvari K ione+ In io3-.
Sintetizira se z reakcijo kalijevega hidroksida z jodijevo kislino: HIO3(aq) + koh (s) => Kio3(aq) + h2Ali (l). Prav tako ga je mogoče sintetizirati z reakcijo molekularnega joda s kalijevim hidroksidom: 3i2(s)+6koh (s) => Kio3(aq) + 5ki (aq) + 3H2Ali (l).
Lastnosti kalijevega yodata
 Kalijev Yodato videz
Kalijev Yodato videz Je bela trdna trdna, fina kristala brez vonja in z monoklinično kristalno strukturo. Ima gostoto 3,98 g/ml, molekulsko maso 214 g/mol in predstavlja absorpcijske pasove v infrardečem spektru (IR).
Ima tališče: 833 ° K (560 ° C), sestavljeno iz močnih ionskih interakcij med K ioni+ In io3-. Pri višjih temperaturah reakcija toplotne razgradnje, ki sprošča molekularni kisik in kalijev jodid:
2kio3(s) => 2ki (s) + 3o2(g)
V vodi ima topnost, ki se giblje od 4,74 g/100ml do 0 ° C, do 32,3 g/100 ml pri 100 ° C, kar ustvarja brezbarvne vodne raztopine. Poleg tega je netopna v alkoholu in dušikovi kislini, vendar je topna v razredčeni žveplovi kislini.
Njegova afiniteta do vode ni opazna, kar pojasnjuje, zakaj ni higroskopska in ne obstaja v obliki hidriranih soli (Kio3· H2Da).
Oksidacijsko sredstvo
Kalijev Yodato, kot kaže njegova kemična formula, ima tri atome kisika. To je močno elektronegativni element in zaradi te lastnosti pušča "odkrito" elektronsko pomanjkanje oblaka, ki obdaja jod.
Vam lahko služi: inertni pliniTo pomanjkljivost - ali prispevek, kot je mogoče - se lahko izračuna kot oksidacijsko število joda (± 1, +2, +3, +5, +7), ki je +5 v primeru te soli.
Kaj to pomeni? Da jih bo jod pred vrsto, ki je sposobna dati svoje elektrone v svoji ionski obliki (io3-) postati molekularni jod in imeti oksidacijsko številko, ki je enaka 0.
Po tej razlagi je mogoče ugotoviti, da je kalijev jodat oksidacijska spojina, ki intenzivno reagira z reducirajočimi sredstvi v številnih redoks reakcijah; Od tega je eden znan kot jodna ura.
Ura joda je sestavljena iz redoks procesa počasnih in hitrih korakov, v katerem hitre korake zaznamuje raztopina Kio3 V žveplovi kislini, ki mu je dodan škrob. Nato škrob -den proizvaja in zasidrana med svojo strukturo Vrsta i3-- Naredila bo barvito modro rešitev temno modro.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 h2Tudi
Yo2 + HSo3- + H2O → 2 i- + HSo4- + 2 h+ (Temno modra zaradi škroba)
Kemična struktura
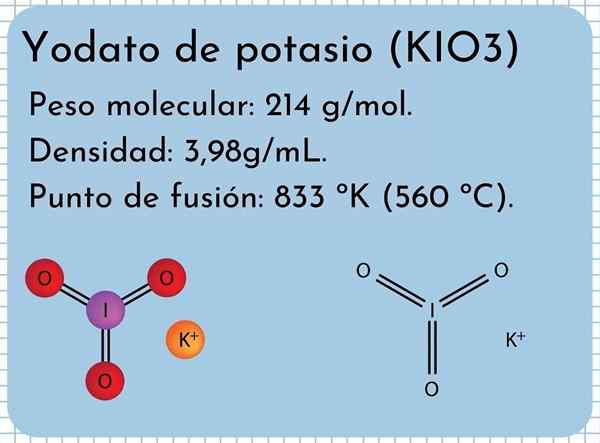
 Struktura kalijevega yodata
Struktura kalijevega yodata Na vrhunski sliki je prikazana kemična struktura kalijevega jodata. Io anion3- Predstavlja ga "stativ" rdeče in vijolične krogle, medtem ko K ioni K+ Predstavljajo jih vijolične sfere.
Toda kaj pomenijo ti stativi? Pravilne geometrijske oblike teh anionov so pravzaprav trigonalne piramide, v katerih kisik sestavlja trikotno podlago, zgoraj pa ne deljeni navor joda, ki zaseda prostor in sili, da zložita povezavo I-O in dve povezavi I = O.
Vam lahko služi: tartarična kislinaTa molekularna geometrija ustreza hibridizaciji SP3 osrednjega atoma joda; Vendar druga perspektiva kaže, da ena od atomov kisika tvori povezave do orbitalnih "d" joda, ki je dejansko hibridizacija vrste SP3d2 (Jod lahko svoje "D" orbitale širijo svojo plast Valencije).
Kristali te soli lahko trpijo strukturne fazne prehode (druge ureditve, ki niso monoklinike) kot posledica različnih fizičnih stanj.
Uporaba in uporabe kalijevega jodata
Terapevtska uporaba
Kalijev Yodato se običajno uporablja za preprečevanje kopičenja radioaktivnosti v ščitnici v obliki 131I, ko se ta izotop uporablja pri določanju joda s ščitnico kot sestavino delovanja ščitnice.
Prav tako se kalijev yodato uporablja kot aktualni antiseptik (0,5 %) v sluznici.
Uporaba v industriji
Hrana plemenskih živali se doda kot jodni dodatek. Zato se v industriji uporablja kalijev yodato za izboljšanje kakovosti moke.
Analitična uporaba
V analitični kemiji se zaradi svoje stabilnosti uporablja kot primarni vzorec pri standardizaciji vzorcev natrijevega tiosulfata (NA2S2Tudi3), z namenom določitve koncentracij joda v težavah.
To pomeni, da lahko z volumetričnimi tehnikami (stopinje) poznamo količine joda. V tej reakciji kalijev jodat hitro oksidira na jodidne ione I-, Skozi naslednjo kemijsko enačbo:
Vam lahko služi: svinčeno acetat: struktura, lastnosti, pridobivanje, uporabeIo3- + 5i- + 6H+ => 3i2 + 3H2Tudi
Jod, jaz2, je naslovljen z raztopino NA2S2Tudi3 za njegovo standardizacijo.
Uporaba v laserski tehnologiji
Študije so pokazale in potrdile zanimive piezoelektrične, piroelektrične, elektrooptične, feroelektrične in nelinearne optične lastnosti kio kristalov3. To ima za posledico velike potenciale na elektronskem polju in v tehnologiji laserjev za materiale, narejene s to spojino.
Zdravstvena tveganja kalijevega Yodata
V visokih odmerkih lahko povzroči draženje v ustni sluznici, koži, očeh in dihalnih poteh.
Poskusi toksičnosti kalijevega jodata pri živalih so nam omogočili, da opazimo, da pri psih na hitro, pri odmerkih 0,2-0,25 g/kg telesne teže, ki se peroralno dobavlja, spojina povzroča bruhanje.
Če se tem bruhanjem izognemo, pri živalih poslabša njihov položaj, saj se anoreksija in pred smrtjo sproži. Njegove obdukcije so dovolile opazovati nekrotične lezije jeter, ledvice in črevesno sluznico.
Zaradi svoje oksidacijske moči predstavlja tveganje za požar, ko pride v stik z vnetljivimi materiali.
Reference
- Dan, r., & Underwood, a. Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall, P-364.
- Kemijna knjiga. (2017). Kalijev jodat. Pridobljeno 25. marca 2018 iz Kemicalbook: Kemicalbook.com
- Pubchem. (2018). Kalijev jodat. Pridobljeno 25. marca 2018 iz Pubchem: Pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Merck. (2018). Kalijev Yodato. Pridobljeno 25. marca 2018 iz Mercka:
- Merckmillipore.com
- M M M Abdel Kader in sod. (2013). Mehanizem transporta naboja in fazni prehodi nizke temperature v Kio3. J. Phys.: Konf. Biti. 423 012036

