Zlati oksid (III) (AU2O3) Kaj je, struktura, lastnosti, uporablja
- 1154
- 171
- Mr. Shane Larkin
On Zlati oksid (iii) To je anorganska spojina, katere kemijska formula je au2Tudi3. Teoretično bi lahko njegovo naravo pričakovali zunaj kovalentnega tipa. Vendar prisotnosti določenega ionskega značaja v njegovi trdni trdni snovi ni mogoče v celoti izključiti; ali kaj je isto, predpostavimo, da odsotnost au kationa3+ zraven aniona oz2-.
Morda se zdi nasprotujoče, da lahko zlato, ki je plemenita kovina, oksidira. V normalnih pogojih zlati koščki ne morejo oksidirati s stikom s kisikom atmosfere; Ko pa jih obsevamo z ultravijoličnim sevanjem v prisotnosti ozona ali3, Panorama je druga.
Če bi zlate zvezde podvrgle te pogoje, bi postale rdečkasto rjava barva, značilna za AU2Tudi3.
Druge metode za pridobitev tega oksida bi pomenile kemično obdelavo teh zvezd; Na primer, spreminjanje testa zlata v svoj klorid, Aucl3.
Nato na aucl3, In ostale možne zlate soli, dodamo močan osnovni medij; In s tem dobimo hidriran ali hidroksidni oksid, AU (OH)3. Končno je slednja spojina toplotno dehidrirana, da dobimo Au2Tudi3.
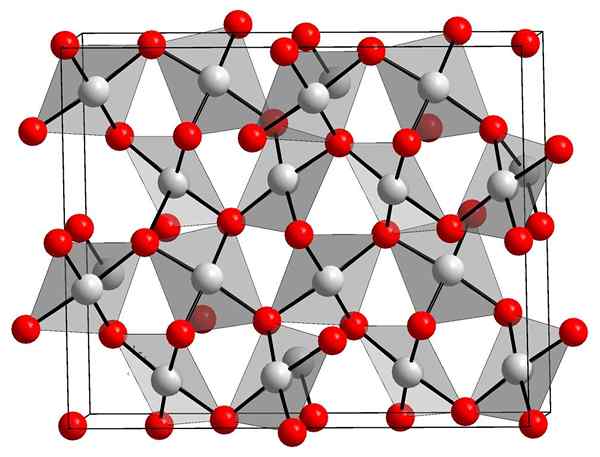
Zlata oksidna struktura (III)
 Kristalna struktura zlatega oksida. Orci, Wikimedia Commons.
Kristalna struktura zlatega oksida. Orci, Wikimedia Commons. Zgornja slika prikazuje kristalno strukturo zlatega oksida (III). Prikazana je razporeditev zlatih in kisikovih atomov v trdni snovi, bodisi glede na nevtralne atome (kovalentna trdna trdna) ali ioni (ionska trdna). Zamenljivo, v vsakem primeru samo odpravite ali postavite povezave AU-O.
Glede na sliko se domneva, da prevladuje kovalentni značaj (ki bi bil logičen). Zaradi tega so prikazani atomi in povezave, predstavljene s kroglami in palicami. Bele krogle ustrezajo zlatim atomom (auIii-O), in rdečkasto do kisikovih atomov.
Vam lahko služi: hidroksiapatitČe ga opazimo natančno, bo razvidno, da obstajajo enote AUO4, ki se vežejo z atomi kisika. Drug način za vizualizacijo bi bil upoštevati, da je vsak AU3+ je obdan s štirimi oz2-; Seveda z joonskega vidika.
Ta struktura je kristalna, ker se atomi urejajo z uboganjem enakega dolgega vzorca. Tako njegova enotna celica ustreza kristalnemu sistemu romboedra (enako kot zgornja slika). Zato vse au2Tudi3 Lahko bi ga zgradili, če bi bile vse te sfere enotne celice razporejene v vesolju.
Elektronski vidiki
Zlato je prehodna kovina in pričakuje se, da njene 5D orbitale neposredno komunicirajo z 2P orbitali kisikovega atoma. To prekrivanje njegovih orbitalov teoretično mora ustvariti gonilne pasove, zaradi česar bi Au naredili2Tudi3 V polprevodniški trdni snovi.
Zato prava struktura AU2Tudi3 je še bolj zapleteno, če ima to v mislih.
Hidrati
Zlati oksid lahko zadrži molekule vode znotraj svojih romboédikanskih kristalov, kar povzroča hidrate. Ko nastanejo takšni hidrati, postane struktura amorfna, torej neurejena.
Kemična formula za take hidrate je lahko katero koli od naslednjih, kar dejansko ni globoko razjasnjeno: AU2Tudi3∙ ZH2O (z = 1, 2, 3 itd.), Au (OH)3, ali auxTudiin(OH)z.
Formula Au (OH)3 predstavlja poenostavitev resnične sestave teh hidratov. To je zato, ker so raziskovalci v okviru zlatega hidroksida (III) ugotovili tudi prisotnost AU2Tudi3; In zato izgubi smisel, da ga izoliramo kot "preprost" hidroksid prehodne kovine.
Vam lahko služi: ravnovesje med tekočino in hlapomNa drugi strani pa trdne s formulo AUxTudiin(OH)z Pričakovati je mogoče amorfno strukturo; Ker je to odvisno od koeficientov x, in in z, katerih različice bi povzročilo vse vrste strukture, ki bi težko pokazale kristalni vzorec.
Lastnosti
Fizični videz
Je rdečkasto rjava trdna.
Molekularna masa
441.93 g/mol.
Gostota
11.34 g/ml.
Tališče
Se topi in razpade pri 160 ° C. Manjka vrelišča, zato ta oksid nikoli ne zavre.
Stabilnost
Au2Tudi3 Je termodinamično nestabilen, ker se, kot je omenjeno na začetku. Tako da se zlahka zmanjša, da postane plemenito zlato.
Višja kot je temperatura, hitrejša bo ta reakcija, ki je znana kot toplotna razgradnja. Tako au2Tudi3 Pri 160 ° C se razgradi, da nastane kovinsko zlato in sprosti molekularni kisik:
2 au2Tudi3 => 4 au + 3 o2
Zelo podobna reakcija se lahko pojavi z drugimi spojinami, ki naklonjene temu zmanjšanju. Zakaj zmanjšanje? Ker zlato pridobi elektrone, ki jih je odstranil kisik; Kaj je isto kot izguba povezav do kisika.
Topnost
Je netopna trdna snov v vodi. Vendar je topna v klorovodikovih in dušikovih kislinah, zaradi nastajanja zlatih kloridov in nitratov.
Nomenklatura
Zlati oksid (III) je ime, ki ga ureja nomenklatura zalog. Drugi načini, kako to omeniti, so:
-Tradicionalna nomenklatura: Aurski oksid, ker je Valencia 3+ največja za zlato.
-Sistematična nomenklatura: dioro trioksid.
Prijave
Obarvanost stekla
Ena njegovih najprimernejših načinov je zagotoviti rdečkasto barvo določenim materialom, kot so kozarce, poleg tega, da podelijo nekatere lastnosti, ki so povezane z zlatimi atomi.
Vam lahko služi: vodikov bromid (HBR)Sinteza auratov in fulminantnega zlata
Če je dodana AU2Tudi3 Do medija, kjer je topen, in v prisotnosti kovin se lahko obori po dodajanju močne baze aurate; ki jih tvorijo auo anioni4- V družbi kovinskih kationov.
Tudi AU2Tudi3 reagira z amonijakom, da tvori fulminantno zlato spojino, au2Tudi3(NH3)4. Njegovo ime izhaja iz dejstva, da je zelo eksplozivno.
Samostojna manipulacija z monokapi
Na zlatu in njegovem oksidu določene spojine niso adsorbirane na enak način, kot so disulfur Dialil, RSSR. Ko se ta adsorpcija zgodi, se spontano tvori vez Au-S, kjer atom žvepla razstavlja in definira kemijske značilnosti omenjene površine, odvisno od funkcionalne skupine, na katero je povezana.
RSSR ni mogoče adsorbirati nad AU2Tudi3, Toda o kovinskem zlatu. Če se torej spreminjajo površina zlata in njena stopnja oksidacije, pa tudi velikost delcev ali plasti AU2Tudi3, lahko je zasnovana bolj heterogena površina.
Ta površina au2Tudi3-AUSR sodeluje s kovinskimi oksidi nekaterih elektronskih naprav in tako razvija prihodnje pametnejše površine.
Reference
- Zlati oksidi. Okrevano od: 911metallurgist.com
- Shi, r. Asahi in c. Stampfl. (2007). Lastnosti zlatih oksidov AU2Tudi3 in au2O: Raziskave prve načele. Ameriško fizično društvo.
- « Chigualcan, kaj je, značilnosti, habitat, uporabe, lastnosti
- Hemidemosomi, kaj je, opis, struktura, funkcije »

