Litijev oksid
- 1759
- 217
- Ignacio Barrows
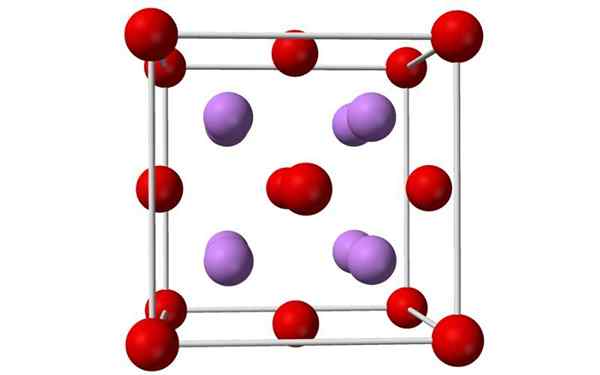
 Kroglice in palice modela enotne celice litijevega oksida. Vir: Benjah-BMM27, Wikimedia Commons
Kroglice in palice modela enotne celice litijevega oksida. Vir: Benjah-BMM27, Wikimedia Commons Kaj je litijev oksid?
On Litijev oksid Je anorganska kemična spojina formule li2Ali to nastane skupaj z majhnimi količinami litijevega peroksida, ko litijeva kovina gori v zraku in se združuje s kisikom.
Do 90. let je na trgu kovine in litija prevladovala ameriška proizvodnja iz mineralnih nahajališč, toda na začetku 21. stoletja je večina proizvodnje izhajala iz drugih virov: Avstralija, Čile in Portugalska so bili najpomembnejši dobavitelji na svetu. Bolivija ima polovico litijevih nahajališč na svetu, vendar ni odličen proizvajalec.
Najpomembnejša komercialna oblika je litijev karbonat, li2Co3, proizvedeno iz mineralov ali salmuelas z več različnimi procesi.
Ko litij gori v zraku, je glavni izdelek beli litijev oksid oksid, Li2Tudi. Poleg tega se pojavi nekaj litijevega peroksida, li2Tudi2, Tudi bela.
To je mogoče storiti tudi s toplotno razgradnjo litijevega hidroksida, lioh ali litijevega peroksida, li, li2Tudi2.
4li (s) + o2(g) → 2li2Ti)
2lioH (s) + toplota → li2Ali (s) + h₂o (g)
2li2Tudi2(s) + toplota → 2li2Ali (s) + oz2(g)
Fizikalne in kemijske lastnosti
- Litijev oksid je bela trdna snov, znana kot Lithia, ki ji primanjkuje arome in ima slan okus.
- Litijevi oksid so kristali z antifloritno geometrijo, podobno kot natrijev klorid (kubični centrirani na obraze).
- Njegova molekulska teža je 29,88 g/mol, njegova gostota je 2.013 g/ml, točke fuzije in vrelišča pa 1438 ° C oziroma 2066 ° C.
Lahko vam služi: epid- Spojina je zelo topna v vodi, alkoholu, etru, piridinu in nitrobenzenu.
- Litijev oksid zlahka reagira z vodno paro, da tvori hidroksid, in ogljikov dioksid, da tvori karbonat; Zato ga je treba shraniti in upravljati v čisti in suhi atmosferi.
- Oksidne spojine ne izvajajo električne energije. Vendar pa so nekateri strukturirani oksidi Perovskita elektronski prevodnost, ki najdejo uporabo v sistemih za proizvodnjo gorivnih celic in nastajanja kisika v trdnem oksidu.
- So spojine, ki vsebujejo vsaj en kisiški anion in kovinski kation.
Tveganja
Litijev oksid je stabilna spojina, ki ni združljiva z močnimi kislinami, vodo in ogljikovim dioksidom. Kolikor vemo, kemične, fizikalne in toksikološke lastnosti litijevega oksida niso bile raziskane in temeljito poročale.
Toksičnost litijevih spojin je funkcija njihove topnosti v vodi. Litijev ion ima toksičnost v centralnem živčnem sistemu. Spojina je zelo jedska, dražilna, če pride v stik z očmi in kožo, ko se vdiha ali zaužije.
V primeru očesnega stika morate preveriti, ali se kontaktne leče uporabljajo in jih takoj odstranite. Vsaj 15 minut jih je treba izpeljati s tekočo vodo, pri čemer so odprte veke. Uporablja se lahko hladna voda in ne mazilo za oči.
Če kemikalija pride v stik z oblačili, jo čim hitreje zadržite in zaščitite svoje roke in telo. Žrtev postavite pod varnostno prho.
Če se kemikalija nabira v izpostavljeni koži žrtve, kot so roke, se koža, onesnažena s tekočo vodo, in ne -Babrazivno milo mehko oprana in previdno. Lahko uporabimo hladno vodo. Če draženje traja, poiščite zdravniško pomoč. Operite onesnažena oblačila, preden jih ponovno uporabite.
Lahko vam služi: Rankine Scale: kaj je, konverzije, primeriV primeru vdihavanja je treba žrtev dovoliti, da stoji na dobro prezračenem območju. Če je vdihavanje resno, je treba žrtev čim prej evakuirati na varno območje.
Odvijte tesna oblačila, kot so vratovi majic, pasovi ali kravata. Če je žrtev težko dihati, je treba dajati kisik. Če žrtev ne diha, je narejena oživljanje ust.
Vedno upoštevamo, da je lahko nevarno za osebo, ki nudi pomoč pri oživljanju ust do ust, kadar je vdihani material strupen, nalezljiv ali koroziven. V vseh primerih je treba iskati takojšnjo zdravniško pomoč.
Prijave
- Litijev oksid se uporablja kot ustanovitelj v keramičnih emajlih in ustvarja modro z bakrom in vrtnicami s kobaltom. Reagira z vodo in paro, ki tvori litijev hidroksid in ga je treba izolirati.
- Litijev oksid (li2O), s svojim visokim tritio potencialom je privlačen kandidat za trdno gojenje materiala DT fuzijske energijske elektrarne zaradi visoke gostote litijevih atomov (v primerjavi z drugo litijevo ali kovinsko litijevo keramiko) in relativno visoke toplotne prevodnosti.
Li2O Izpostavljena bo visokim temperaturam pod nevtronskim obsevanjem med delovanjem fuzijskih odej. V teh okoliščinah bo v LI proizvedeno veliko število napak pri obsevanju2Ali, na primer oteklina, ki jo povzroča helij, razmeroma visoka toplotna ekspanzija, rast zrn, tvorba in padavine LyH (T) pri nizkih temperaturah in prevozu mase LIOH (T) pri visokih temperaturah.
Poleg tega Li2Ali bodo podvržene napetosti, ki izhajajo iz razlik med toplotno ekspanzijo med Li2O in strukturni materiali. Te značilnosti Li2Ali vodijo do zahtevnih inženirskih težav tako v proizvodnji kot pri oblikovanju mante.
Vam lahko služi: stroncijev hidrid (SRH2)- Možna nova uporaba je kot zamenjava za kobalt in litijev oksid, kot je katoda v litij -iionskih baterijah, ki se uporabljajo za povečanje elektronskih naprav za mobilne telefone na prenosnike, kot tudi avtomobile z baterijami.
Reference
- Ameriški elementi. Litijev oksid. Okrevano od ameriških ameriških.com.
- Litijev oksid. Okrevano od Espimetals Espimetals.com.
- Litijev oksid (LI2O). FERP je okreval.UCSD.Edu ferp.UCSD.Edu.

