Struktura tin oksida (ii), lastnosti, nomenklatura, uporablja

- 1524
- 224
- Mr. Shane Larkin
On kositerni oksid (ii) To je kristalna anorganska trdna snov, ki jo tvori oksidacija kositra (sn) s kisikom, kjer kositer pridobi Valencia 2+. Njegova kemična formula je sno. Znani sta dva različna načina te spojine: črna in rdeča. Pogosta in najbolj stabilna oblika pri sobni temperaturi je črna ali črno-modra sprememba.
To obliko pripravimo s hidrolizo tin klorida (ii) (sncl2) V vodni raztopini, ki ji dodamo amonijev hidroksid (NH4Oh) pridobiti oborino hidriranega oksida iz Sn (ii), katerega formula je sn.Xh2Ali, kje x<1 (x menor que 1).
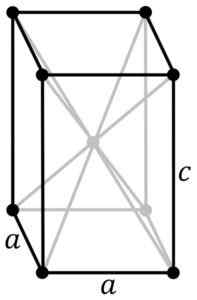 Tetragonalna kristalna struktura črno-modrega sno. Atom SN se nahaja v središču strukture in kisikovih atomov v točki vzporednic. Originalni pngs by uporabnik: rocha, v Inkcapeju v Inkcapeu uporabnik: STANNERED [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]] Vir: Wikipedia Commons
Tetragonalna kristalna struktura črno-modrega sno. Atom SN se nahaja v središču strukture in kisikovih atomov v točki vzporednic. Originalni pngs by uporabnik: rocha, v Inkcapeju v Inkcapeu uporabnik: STANNERED [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]] Vir: Wikipedia Commons Hidrirani oksid je bela amorfna trdna snov, ki se nato segreva v suspenziji na 60-70 ° C v prisotnosti NH4Oh, dokler ne dobiš črne kristalne čiste sno.
Rdeča oblika sno je metastabilna. Pripravimo ga lahko z dodajanjem fosforne kisline (h3Po4) - z 22% fosforno kislino, h3Po3 - In potem nh4Oh SNCL rešitev2. Pridobljena bela snov segreva v isti raztopini do 90-100 ° C približno 10 minut. Na ta način dobimo čisti rdeči kristalni sno.
Kositrni oksid (II) je izhodiščni material za proizvodnjo drugih kositrnih spojin (II). Zaradi tega je ena od kositrnih spojin, ki ima pomemben komercialni pomen.
Kositerni oksid (ii) predstavlja nizko strupenost kot pri večini tin -inorganskih spojin. To je posledica njihove slabe absorpcije in hitrega izločanja tkanin živih bitij.
Lahko vam služi: bipe beraral: kaj je, značilnosti, za kaj jePredstavlja eno največjih toleranc kositrnih spojin v testih, opravljenih s podganami. Vendar je lahko škodljivo, če se vdiha v velikih količinah.
[TOC]
Struktura
Tin oksid (ii) črno-modri
Ta sprememba kristalizira s tetragonalno strukturo. Ima plast.
Drugi raziskovalci trdijo, da je vsak atom SN obkrožen s 5 atomi kisika, ki so približno v točki oktaedra, kjer je šesti toli. To je znano kot φ-oktična ureditev.
Rdeči kositerni oksid (ii)
Ta oblika tin oksida (ii) kristalizira z ortrorombično strukturo.
Nomenklatura
- Kositerni oksid (ii)
- Estany oksid
- Kositerno monoksid
- Estany oksid
Lastnosti
Fizično stanje
Kristalna trdna.
Molekularna teža
134,71 g/mol.
Tališče
1080 ° C. Razpade.
Gostota
6,45 g/cm3
Topnost
Netopna v hladni ali vroči vodi. Netopna v metanolu, vendar se hitro raztopi v kislinah in koncentriranih alkalijih.
Druge lastnosti
Če se v prisotnosti zraka segreva več kot 300 ° C, se kositrni oksid (II) hitro oksidira v kositrnem oksidu (iv), ki predstavlja žarnost.
Poročalo se je, da ima ogrevanje tin oksida (II) ogrevanje v ne-oksidantih različne rezultate glede na stopnjo čistosti začetnega oksida. Na splošno je nesorazmeren v kovinskem sn in kositrnem oksidu (iv), sno2, Z različnimi vmesnimi vrstami, ki končno postanejo sno2.
Tin oksid (ii) je amfotero, saj se raztopi v kislinah, da daje ione sn2+ ali anionske komplekse in se tudi v alkaliji raztopi, da tvori ionske rešitve za hidroksi, SN (OH)3-, ki imajo piramidalno strukturo.
Lahko vam služi: perklorna kislina: formula, značilnosti in uporabePoleg tega je SNO reducirajoče sredstvo in hitro reagira z organskimi kislinami in minerali.
V primerjavi z drugimi kositrnimi solmi predstavlja nizko strupenost. Njegov DL50 (50% smrtonosni odmerek ali srednji smrtonosni odmerek) pri podganah je več kot 10000 mg/kg. To pomeni, da je za ubijanje 50% podgan v določenem preskusnem obdobju potrebno več kot 10 gramov na kilogram. Za primerjavo Tin Fluorid (II) predstavlja 188 mg/kg DL50.
Če pa ga vdihava dlje časa, se odlaga v pljuča, ker se ne absorbira in lahko proizvede kositer (infiltracija sno prahu v pljučnih intersticah).
Prijave
V proizvodnji drugih kositrnih spojin (ii)
Njegova hitra reakcija s kislinami je osnova njegove najpomembnejše uporabe, ki je kot posrednik pri proizvodnji drugih kositrnih spojin.
Uporablja se pri proizvodnji kositra bromida (ii) (snbr2), Kositer cianid (ii) (sn (cn)2) in tin fluoroborat hidrat (ii) (sn (bf4)2), Med drugimi kositrnimi spojinami (ii).
Kositer fluoroborat (II) se pripravi z raztapljanjem. To je med drugim posledica njegove visoke pokritosti.
Kositer (ii) oksid se uporablja tudi pri pripravi kositra sulfata (ii) (snso4), s sno in reakcijo žveplove kisline, h2SW4.
Snso4 Pridobljeno se uporablja v konzerviranem postopku za proizvodnjo tiskanih krožnikov, za električni kontaktni zaključek in za kuhinjske pripomočke.
Vam lahko služi: aluminijev karbonat: struktura, lastnosti, uporabe Natisnjeno vezje. Noben strojno berljiv avtor ni zagotovil. Domneval je Abraham Del Pozo (na podlagi zahtevkov za avtorske pravice). [Javna domena] Vir: Wikimedia Commons
Natisnjeno vezje. Noben strojno berljiv avtor ni zagotovil. Domneval je Abraham Del Pozo (na podlagi zahtevkov za avtorske pravice). [Javna domena] Vir: Wikimedia Commons Hidrirana oblika SNO, Tin Hydrotado (ii) SNO.Xh2Ali pa se zdravi s fluorhorhoric kislino, da dobimo kositrni fluorid (II), SNF2, ki se dodajo dentifric kremam kot agent za boj proti kariesu.
V nakitu
Tin oksid (II) se uporablja pri pripravi kristalov zlata in bakrenih števk. Očitno je njegova funkcija v tej aplikaciji delovati kot reducirajoče sredstvo.
 Dragulj z Ruby. Vir: Pixabay
Dragulj z Ruby. Vir: Pixabay Druge uporabe
Uporablja se v fotovoltaičnih napravah za proizvodnjo električne energije iz svetlobe, kot so sončne celice.
 Fotovoltaična naprava. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licence/by-sa/2.5)] Vir: Wikipedia Commons
Fotovoltaična naprava. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licence/by-sa/2.5)] Vir: Wikipedia Commons Nedavne inovacije
Nanodelci, naročeni s sno.
 Nano vlakna sno hidrata. Fionán [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Vir: Wikipedia Commons
Nano vlakna sno hidrata. Fionán [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Vir: Wikipedia Commons Pripravljene elektrode SNO imajo visoko prevodnost in malo sprememb v količini v ponavljajočih se ciklih nalaganja in prenosa.
Poleg tega SNO olajša hitro prenos ionov/elektronov med reakcijami oksidacije, ki se pojavijo v takšnem baterijskem sistemu.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ples, j.C.; Emeléus, h.J.; Sir Ronald Nyholm in Trotman-Deckenson,.F. (1973). Celovita anorganska kemija. Zvezek 2. Pergamon Press.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A27. VCH Verlagsgellschaft MBH.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 24. Četrta izdaja. John Wiley & Sons.
- Ostrakhovitch, Elena. In cherian, m. George. (2007). Kositer. V priročniku toksikologije kovin. Tretja izdaja. Okrevano od Scientirect.com.
- Kwestroo, w. in Vromans, str.H.G.M. (1967). Priprava treh modifikacij čistega (ii) oksida. J. Inorg. Nucl. Kem., 1967, vol.29, str.2187-2190.
- FOUD, s.S et al. (1992). Optične lastnosti tankih filmov z oksidom. Češkoslovak Journal of Physics. Februar 1992, letnik 42, številka 2. Okreval od Springerja.com.
- A-young Kim in sod. (2017). Naročene SNO nanodelce v MWCNT kot funkcionalni gostiteljski material za visokorazredno katodo litij-sulphur. Nano Research 2017, 10 (6). Okreval od Springerja.com.
- Nacionalna knjižnica medicine. (2019). Običajni oksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- « Zgodovina, operacija Jacquard statve, uporablja
- Funkcionalizem (arhitektura) Zgodovina, značilnosti, dela »

