Struktura kromiranega oksida (III), nomenklatura, lastnosti, uporablja

- 4891
- 651
- Cary Goyette
On Krom oksid (iii) U kromični oksid je anorganska zelena trdna trdna snov, ki nastane s kurjenjem kromne kovine (CR) v kisiku (ali2), pri čemer zapustite krom s stanjem oksidacije 3+. Njegova kemična formula je cr2Tudi3. V naravi ga najdemo v mineralu Eskolaíta. Naravna nahajališča kromiranega oksida (III) niso znana.
Med drugim ga je mogoče pripraviti s segrevanjem CR2Tudi3 hidrirani (cr2Tudi3.Nh2O) popolnoma odstraniti vodo. Dobimo ga tudi kot produkt kalcinacije kromovega oksida (VI) (CRO3).
 Pigment kromiranega oksida (iii). FK1954 [javna domena]. Vir: Wikipedia Commons
Pigment kromiranega oksida (iii). FK1954 [javna domena]. Vir: Wikipedia Commons Vendar je najboljši način, da ga dosežemo čist, z razgradnjo amonijevega dikromata (NH4)2Cr2Tudi7 pri 200 ° C. Industrijsko nastaja z zmanjšanjem natrijevega dikromata (NA2Cr2Tudi7) trdno z žveplom.
Ko je fino razdeljen, predstavlja svetlo zeleno barvo z rumenkasto nianso. Če pa so delci večji, ima modrikasto barvilo. Kromni oksid je najbolj stabilen zeleni pigment, ki je znan. Njegova toplotna in kemična odpornost je dragoceno keramično barvilo.
Uporablja se v industrijskih premazah, lakih, v gradbeni industriji, v nakitu, kot barvanje v kozmetiki ali v farmacevtskih izdelkih, med drugimi aplikacijami.
[TOC]
Struktura
Α-CR oksid2Tudi3 Ima strukturo tipa Corindon. Njegov kristalni sistem je romboonic šesterokotni. Je izomorfna z α-alumina in α-Fe2Tudi3.
Eskolaíta, naravni mineral kromiranega oksida (III), predstavlja spodnjo strukturo:
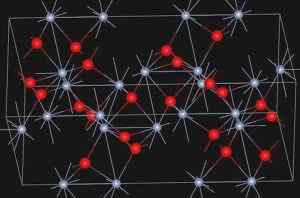 Kristalna struktura minerala Eskolaíta. https: // nalaganje.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Vir: Wikipedia Commons
Kristalna struktura minerala Eskolaíta. https: // nalaganje.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Vir: Wikipedia Commons Nomenklatura
- Krom oksid (iii).
- Zeleni krom oksid.
- Trioksid dihroma.
- Kromium Seaquioxid.
- Kromia.
- Eskolaíta: mineral kromiranega oksida (iii).
- Hidrat: cr2Tudi3.Nh2Ali (kjer se n ≅ 2) imenuje kromiran oksid hidrat (III) ali Guignet Green.
 Kromirani oksidni hidrat (III). W. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons
Kromirani oksidni hidrat (III). W. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons Lastnosti
Fizično stanje
Kristalna trdna.
Mohs trdota
9 (njihovi kristali so izjemno trdi).
Molekularna teža
151,99 g/mol.
Vam lahko služi: kvartarne spojine: značilnosti, usposabljanje, primeriTališče
Stopi pri 2435 ° C, vendar začne izhlapevati do 2000 ° C, ki tvorijo oblake zelenega dima.
Gostota
5.22 g/cm3
Topnost
Ko se je segrevala pri visokih temperaturah, je v vodi praktično netopna (3 mikrogrami/l pri 20 ° C); netopna v alkoholih in acetonu; rahlo topno v kislinah in alkaliji; Perklorična kislina ssoluble (hclo4) do 70%, v katerem se pokvari.
ph
6.
Lomni količnik
2.551.
Druge lastnosti
- Če je močno kalciniran, postane inerten do kislin in baz. Sicer cr2Tudi3 in njena hidrirana oblika cr2Tudi3.Nh2O so amfoterični, zlahka se raztopijo v kislini, da dajo akva -ione [cr (h2Da)6]3+, in v koncentrirani alkaliji, da tvorijo "kromitos".
- Ko je kalciniran, je kemično odporen na kisline, alkalije in visoke temperature. Je izjemno stabilen2.
- Ima izjemno odpornost proti svetlobi, ker imajo njeni kristali motnost, visoko oslabitev UV in preglednost vidne svetlobe.
- Je izjemno trd material, lahko opraskate kremen, tapacio in cirkonio.
- Njegov hidratni cr2Tudi3.Nh2Ali (kjer n ≅ 2) nima toplotne stabilnosti, njegova hidracijska voda omejuje njegovo uporabnost na manj kot 260 ° C. Predstavlja nizko barvanje in omejen niansi odtenkov.
- Toda ta hidrat ima zelo čist in svetlo zeleno-modri odtenek. Je polzračen, predstavlja nizko motnost, odlično odpornost proti svetlobi in odpornost na alkalije.
- Cr2Tudi3 Ni razvrščen kot nevaren material in velja za inerten fini prah. Ne veljajo mednarodni prometni predpisi.
- Ne draži kože ali sluznice.
Prijave
V keramični in stekleni industriji
CR zaradi visoke odpornosti na toploto in kemično odpornost2Tudi3 Kalcinirano se uporablja kot barvanje za barvanje ali vitrifirajoči pigment v proizvodnji keramike, v porcelanskih skleninih in mešanicah za steklo.
V industrijskih premazih
Keramika s kromiranim oksidom (III) zagotavlja odlično odpornost proti večini korozivnih okolij. Vse to z mehanizmom izključitve okoliške podlage.
Zaradi tega se uporablja v premazih za preprečevanje korozije številnih materialov, ki jih nanese toplotno razpršilo (atomizacija ali vroča rosa).
Lahko vam služi: Kemični postopek: načela, vrste, primeriUporablja se tudi kot zaščita pred abrazivno obrabo (ko odstranitev materiala povzročijo delci, ki se premikajo skozi površino).
V teh primerih uporaba CR prevleke2Tudi3 Z odlaganjem s plazmo ustvarja visoko odpornost.
Prejšnja dva primera imata na primer v plinskih turalnih turbinskih motorjih.
V ognjevzdržni industriji
Uporablja se v toplotno in kemično odpornih opekah, materialih za prevleke in ognjevzdržnem betonu na osnovi alumine.
V gradbeništvu
Ker je izjemno odporen na atmosferske razmere, svetlobo in toploto, se nanese kot granulirano kamnito barvilo za asfaltne strehe, betonski cement, visokokakovostni industrijski premazi za zunanjost, jeklene konstrukcije in fasade (emulzivne barve).
Kot pigment v raznolikih aplikacijah
Podpira lahko pogoje vulkanizacije in se ne poslabša, zato se uporablja pri gumijasti pigmentaciji.
Ker so netehnični, se uporablja kot pigment za igrače, kozmetiko (zlasti njegov hidrat), plastika, tiskarske črnila, slike, ki pridejo v stik s hrano in farmacevtskimi izdelki.
V pigmentni industriji se uporablja kot surovina za proizvodnjo prodornih barvil, ki vsebujejo krom in pigmente, ki temeljijo na fazah mešanih kovinskih oksidov. Uporablja se tudi kot barvanje slik za prevleko.
Njegov hidrat ima preglednost, ki omogoča oblikovanje polikromatskih zaključkov v avtomobilski industriji (kovinski avtomobil).
Zaradi svoje edinstvene značilnosti odseva infrardečega sevanja (IR), podobno rastlinam klorofila, se pod infrardečo svetlobo zdi listje. Zaradi tega je njegova uporaba v kamuflažnih slikah ali premazih za vojaške aplikacije zelo razširjena.
V nakitu
Uporablja se kot barvilo sintetičnih draguljev. Ko je CR uveden2Tudi3 kot nečistoča v kristalni mreži α-al2Tudi3, Kot v poldražnem mineralu Ruby je tudi barva namesto zelene barve.
Uporablja se tudi kot mletje in polirano za visoko trdoto in abrazivne lastnosti.
O kemičnih reakcijah
Podprta v glinici (do2Tudi3) ali drugi oksidi se uporablja pri organski kemiji kot katalizator, na primer pri hidrogeniranju estrov ali aldehidov, da tvori alkohole in pri ciklizaciji ogljikovodika. Katalizira reakcijo dušika (n2) z vodikom (h2) Oblikovati amoniak (NH3).
Lahko vam služi: litij: zgodovina, struktura, lastnosti, tveganja in uporabeZa njegovo oksidno redukcijsko sposobnost, ki deluje skupaj s kromovim oksidom (VI), ima pomembno vlogo pri dehidrogenaciji alkanov2 Za proizvodnjo propeno in izobutena, saj je cikel deaktivacije katalizatorja enostavno izvedljiv. Uporablja se tudi kot katalizator v anorganski kemiji.
V proizvodnji kromiranja
Uporablja se v čisti aluminotermalni proizvodnji kovine. Če želite to narediti, ga je treba segreti na 1000 ° C, da se poveča velikost zrnja.
 Priprava kromiranja kovin z aluminotermičnim redukcijo kromovega oksida (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons
Priprava kromiranja kovin z aluminotermičnim redukcijo kromovega oksida (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons V magnetnih materialih
V majhnih količinah je bil dodan magnetnim materialom zvočnih in video posnetkov z poučevanjem samoimpresivnega učinka na zvočne glave.
Nedavne inovacije
Pridobljeni so bili pigmenti, ki so izboljšali odbojnost blizu nanodelce dopar Cr2Tudi3 s soli elementov, ki pripadajo redki zemeljski skupini, kot sta Lantano in Praseodimio.
Povečanje koncentracije teh elementov se sončna odbojnost bližnjega infrardečega poveča, ne da bi to vplivalo na zeleno barvo prašiča CR2Tudi3.
To omogoča razvrščanje CR2Tudi3 doping kot "hladen" pigment, ker je primeren za nadzor nad kopičenjem toplote.
Uporablja se za strope, avtomobile in oblazinjenje med drugimi aplikacijami dosega visoko odbojnost sončne svetlobe, kar nam omogoča znatno zmanjšanje povečanja toplote v okolju.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 19. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A7 in A20. VCH Verlagsgellschaft MBH.
- Ameriški elementi. (2019). Krom (iii) oksid. Okrevana od ameriških.com.
- Nacionalna knjižnica medicine. (2019). Krom (iii) oksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Dorfman, Mitchell R. (2012). Termični razpršilni premazi. V priročniku za degradacijo okolja materialov. Poglavje 19. Okrevano od Scientirect.com.
- Takehira, k. et al. (2004). Co2 Dehidrogenacija propana nad CR-MCM-41 katalizatorjem. V študijah površinske znanosti in katalize 153. Okrevano od Scientirect.com.
- Selvam Sangeetha in sod. (2012). Funkcionalni pigmenti iz kroma (III) nanodelce oksida. Barvila in pigmenti 94 (2012) 548-552. Okrevano od Scientirect.com.

