Struktura torio, lastnosti, pridobivanje, uporabe

- 3409
- 624
- Mr. Shane Larkin
On Torio To je kovinski element, ki spada v serijo aktinidov, tako imenovanih redkih Zemlje in katerih kemični simbol je th. Ima atomsko število 90 in atomsko težo 232 g/mol. Torio spojine ga običajno vsebujejo s številko oksidacije +4 (th4+).
Spojina Torio dioksida, tho2, Industrijsko je znan kot Toria in se uporablja v večini aplikacij Torium, za katerega je značilno, da je kemična spojina z največjo tališče (3.300 ° C).
 Vzorec kovinskega torija, shranjen v steklenem omotu pod argonom. Njegova črna prevleka je posledica njegovega oksida. Vir: Alchemist-HP (pogovor) (www.PSE-Mendelejew.de) / fal
Vzorec kovinskega torija, shranjen v steklenem omotu pod argonom. Njegova črna prevleka je posledica njegovega oksida. Vir: Alchemist-HP (pogovor) (www.PSE-Mendelejew.de) / fal Torio je leta 1828 odkril maltar Thrane Esmark, ki je na norveškem otoku Løvøya našel črni mineral. Esmark je mineral dostavil Jöns Jacobu Berzeliusu, ki ga je analiziral, da je v njem našel neznano kovino.
Črni mineral je poimenoval kot Torita (Thorita) v čast skandinavskega boga Thorja. Medtem so neznano kovino imenovali Torio (Thorium). Radioaktivni značaj torija sta ustanovila Anton Edward Van Arkel in Jan Hendrik de Boer, neodvisno pa Pierre Curie in Marie Curie.
[TOC]
Torijeve lastnosti
Fizično
Torij je radioaktivni, svetli, zmerno trdi, srebrni, nodularni in popetljivi beli kovina, ki zelo počasi megle v zraku, postanejo sivi in kasneje črni barvi. Pripada skupini aktinidov, ki se identificira z atomsko številko 90 in atomsko maso 232 g/mol.
Radioaktivnost
Torio-232 (232Th90) predstavlja več kot 99% celotnega elementa torija, ki je prisoten v Zemljini skorji. Lahko se šteje, da gre za stabilen izotop, čeprav je radioaktiven, saj je njegova polovica življenja 1.405 x 1010 leta. Radioaktivno upada z emisijo α in β delcev ter γ sevanje.
Torio-232 se spremeni v radio-268 (268Ra88) z izdajo alfa delca, ki ga sestavljata dva protona in dva nevtrona. Torij lahko utrpi vrsto radioaktivnih razpadov, dokler ne postane stabilen element: LEAD-208.
Vam lahko služi: svinčeno klorid: lastnosti, struktura, uporabeTorio-232 lahko ujame nevtrone, da se preoblikujejo v radioaktivni element urana-233 in oddajajo sevanje β tipa. Uran se na drugi strani uporablja v jedrskih reaktorjih za proizvodnjo energije.
Reaktivnost
Torij je elektropozitivna in zelo reaktivna kovina. V zraku zelo počasi oksidira, čeprav se lahko po več mesecih pojavi korozija. Ko se segreva v zraku, se vklopi in oddaja svetlo belo luč, medtem ko proizvodnja Torio dioksida, Tho2.
V standardnih temperaturnih in tlačnih pogojih torij počasi napade voda. Prav tako se torij ne raztopi v najpogostejših kislinah, razen klorovodikove kisline, kjer se raztopi.
Prav tako se raztopi v koncentrirani dušikovi kislini z majhno količino katalitičnega ali fluorozilikalnega fluorida. Torij je piroforična kovina: ko postane praška, se lahko spontano vžge.
Struktura
Atomi Torio tvorijo kubično strukturo kristal, osredotočen na obraze (FCC) pri sobni temperaturi. Ko se segreje nad 1360 ° C, steklo trpi prehod na kubično fazo, osredotočeno na telo (BCC), z nižje gostote. Medtem pa torij pod visokimi pritiski (100 GPa ali več) pridobi gosto tetragonsko strukturo, osredotočeno na telo (BCT).
Elektronska konfiguracija
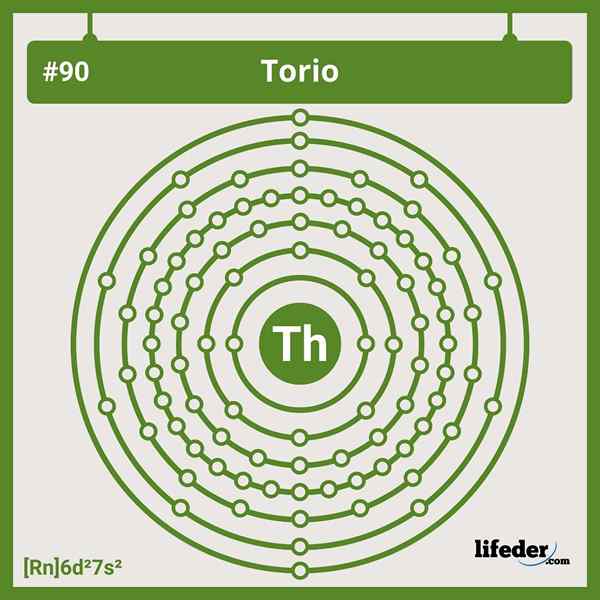 Elektronske nastavitve torija
Elektronske nastavitve torija Skrajšana elektronska konfiguracija za torij je naslednja:
[RN] 6d2 7s2
Izguba štirih elektronov Valencije se preoblikuje v kation4+. Upoštevajte, da kljub temu, da je igral, nima elektronov v svojih 5F orbitalih, v nasprotju z drugimi aktinidi.
Vam lahko služi: faza razprševanjaPridobivanje
Glavni mineral, ki se uporablja za pridobivanje torija, je Monacit. Začetni korak je njegova ločitev od primarnega nahajališča: Pegmatita. Karbonate alkalinoternih kovin izločajo iz pegmatita z reakcijo njihovih fragmentov z vodikovim kloridom.
Nastali fragmenti so kalcinirani in filtrirani, nato pa se podpirajo magnetno ločitev. Tako dobimo peščeni material Monacite. Ta pesek je podvržen 93%prebavi žveplove kisline pri temperaturi od 210 do 230 ° C in nekaj ur. Nastala kislinska raztopina se kasneje razredči z vodo desetkrat večjo prostornino.
Monacitini ostanki se potopijo na dno, medtem ko torij in drugi elementi redke zemlje plavajo v pripravi kisline. PH do 1 je prilagojen.3, ki proizvaja padavine torija kot fosfat, preostala redka zemlja v suspenziji pa ostane v raztopini.
Trenutno se ločitev in čiščenje izvajata z uporabo tekočih topil, na primer poklon fosfatu v Queroseno.
Torio kovina se lahko pojavi v komercialnih količinah z zmanjšanjem metaltermalnega zmanjšanja Totrafluoruro de Torio (THF4) in torio dioksid (th tho2) ali z elektrolizo torijevega tetraklorida (THCL4).
Prijave
Torij je imel veliko aplikacij, od katerih jih je veliko zavrženih od petdesetih let prejšnjega stoletja, ker je njen radioaktivni značaj predstavljal tveganje za zdravje.
Industrijalisti
Zlitine
Torij je bil zlitin z volframom kot elektroda v tig varilniku (volframov inertni plin), ki predstavlja 2% zlitine.
V majhnih količinah je bil v volframovih filamentih dodan Torio za zmanjšanje njene kristalizacije, s čimer se omogoči emisiji elektronov do zniževanja temperatur. V elektronskih cevi in v elektrodah cevi za rentgenske in usmeritve so bile uporabljene žice za volframo.
Torio dioksid je bil uporabljen pri varjenju z volfrakom, saj se odpornost na volframove na visoke temperature kovinskih elektrod povečuje. Vendar pa so jo v tej aplikaciji zamenjali okrožni, cerio ali lantano oksidi.
Vam lahko streže: od kod plastika? Zgodovina in vrsteStrela
Totrafluoruro de Torio je bil na drugi strani uporabljen kot material za zmanjšanje refleksov v optičnih prevlek multicapa, ki so prozorni do svetlobe z valovno dolžino med 0.350 do 1.2 µm. Vendar je Torio Salt v tej uporabi nadomestil Tetrafluoruro de lantano.
Torio dioksid je bil uporabljen pri osvetlitvi svetlobe za oddajanje briljantne luči, ki ustreza vidni svetlobi. Čeprav se v tej aplikaciji še vedno uporablja torij, ga je delno nadomestil ITE.
Ognjevzdržni materiali
Torij je bil uporabljen tudi pri izdelavi ognjevzdržnih materialov za metalurško industrijo in v keramičnih krizolih za poučevanje in raziskovalne laboratorije.
Jedrski reaktorji
Torio-232 se uporablja v jedrskih reaktorjih za lov nevtronov s počasnim gibanjem, saj se to spremeni v uran-233. Ta radioaktivni element je fizično in se uporablja za proizvodnjo energije.
Razvoj jedrskih reaktorjev, ki temeljijo na Torio-32. Jedrski reaktorji Torio-232 ne oddajajo plutonija, zaradi česar so manj onesnaževanja.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Torij. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji (2020). Torij. Pubchem Comunund Povzetek za CID 23974. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Doktor. Doug Stewart. (2020). Dejstva o toriju. Okrevano od: Chemicool.com
- Uredniki Enyclopeedia Britannica. (2020). Torij. Okrevano od: Britannica.com
- Lentech b.V. (2020). Torij. Okrevano od: Lentech.com
- Rachel Ross. (1. marec 2017). Dejstva o toriju. Okrevano od: Livescience.com
- Advameg. (2020). Torij. Okrevano od: Kemiji.com

