02 Vrsta povezave
- 1817
- 342
- Mr. Shane Larkin
Kaj je povezava 02?
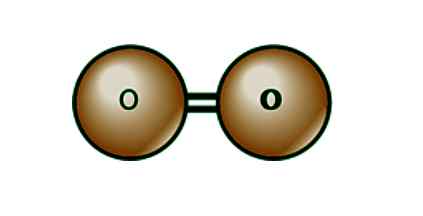
On O2 ali kisikova povezava To je dvojna kovalentna kemična povezava, to je, da se atomi, ki sestavljajo to zvezo.
V tem procesu ima vsak atom kisika šest elektronov v svoji strukturi. Tako je treba za dajanje vezi O2 dva njegova elektrona deliti z drugim atomom kisika in dokončati osem.
Lahko rečemo, da je ta vrsta povezave bistvenega pomena za življenje na Zemlji, tako za ljudi kot za živali in rastline. Poleg tega je nepogrešljivo za nastanek Zemljine atmosfere.
Kako je povezava O2?
Povezava O2 je dvojna kovalentna vrsta, saj si deli dva elektrona z drugim atomom enakih značilnosti. Z drugimi besedami, obstaja zveza teh delcev, ki povzročijo povezavo s kisikom.
 Povezava s kisikom
Povezava s kisikom Pomembno je omeniti, da znotraj kemikalije obstajajo polarne in ne -polarne kovalentne vezi (apolar). Prvi so tisti, ki elektrone ne delijo enako, v drugem.
Zato je mogoče ugotoviti, da je povezava O2 apolarna, saj so njeni skupni delci pravični. Z drugimi besedami, vsaka molekula kisika sestavljata dva atoma istega.
Kot smo že omenili, je povezava s kisikom ali tipom O2 temeljni element za celo življenje na planetu Zemlja, saj je element na brezbarven, inolori in brez okusa, kar lahko v normalnih temperaturnih pogojih doseže vašo povezavo elektronov.
Vam lahko služi: kaj je kemična kinetika?Po drugi strani je pomembno omeniti, da je velik del vode sestavljen iz vezi O2, zaradi česar je veliko življenjskih oblik planeta v njihovih celicah to kemično spojino.
Poleg tega obstaja spojina, ki deli zemeljsko atmosfero s kisikom in je O3 ali ozon. Ta element je zadolžen za zaščito planeta pred sevanjem in ultravijoličnimi žarki pred soncem.
Drugi elementi, podobni povezavi O2
Nekateri drugi apolarni kovalentni elementi, kot je kisik, so lahko H2 ali vodik, kjer se delita dva elektrona med tem, da tvorita ta element. Prav tako obstaja N2 ali dušik, kjer vsaka molekula vodika vsebuje dva atoma istega.
Kot podobni kemični elementi obstajajo tudi S8 ali žveplo, CH4 ali metan, C4H10 ali butan, ki si za razliko od O2 delijo več kot nekaj elektronov. Vendar so še vedno stabilni elementi z apolarno kovalenco, kot je kisik.
Obstajajo tudi elementi, kot so CO2 ali ogljikov dioksid ali CCL4 ali ogljikov tetraklorid, ki, čeprav jih tvorijo različni atomi.

