Natrijev tiosulfat (Na2S2O3)

- 4614
- 632
- Roman Schamberger
 Natrijeve tiosulfatne soli. Z licenco
Natrijeve tiosulfatne soli. Z licenco Kaj je natrijev tiosulfat?
On Natrijev tiosulfat ali natrijev hiposulfit (Na2S2Tudi3) Je pomembna anorganska sol z več medicinskimi uporaba. Na voljo je tudi kot vaša pentahidratna sol (NA2S2Tudi3.5H2Da).
Gre za ionsko spojino, ki jo tvorita dva natrijeva kationa (NA+) in negativno obremenjeni tiosulfatni anion2Tudi3-), v katerem je atom osrednjega žvepla povezan s tremi atomi kisika in drugim atomom žvepla (od tod predpona -tio), prek preprostih in dvojnih vezi z resonančnim znakom. Trdna snov obstaja v monoklinski kristalni strukturi.
Natrijev tiosulfat lahko pripravi grelni žveplo z vodno raztopino natrijevega sulfita ali vodno raztopino natrijevega hidroksida.
6naOH + 4S → NA2S2Tudi3 + 2. mesto2S + 3H2Tudi
To je zdravilo, ki je na seznamu osnovnih zdravil Svetovne zdravstvene organizacije, najučinkovitejša in najučinkovitejša zdravila, ki so potrebna v zdravstvenem sistemu.
Fizikalne in kemijske lastnosti
- Natrijev tiosulfat ima molekulsko maso 158,11 g/mol za brezvodno obliko in 248,18 g/mol za obliko pentahidrata.
- Predstavlja gostoto 1.667 g/ml.
- Natrijev tiosulfat je brezbarven monoklinski kristal brez značilne arome. Ta trdna snov je izliv, kar pomeni, da jo je mogoče s izgubo kristalizacijske vode, ko je izpostavljena zraku.
- Spojina ima tališče 48 ° C za obliko pentahidrata, od 100 ° C.
- Na2S2Tudi3 V vodi je zelo topen, saj lahko raztopi 70 gramov na 100 mililitrov topila. Spojina je v etanolu praktično netopna.
Vam lahko služi: absorpcijski spekter- Natrijev tiosulfat je nevtralna sol, ki zlahka disociira v vodi, da daje natrijeve in tiosulfatne ione. Na2S2Tudi3 Je stabilna trdna snov v normalnih pogojih, vendar se razpade, ko se segreje, da daje natrijev sulfat in natrijev polisulfid:
4na2S2Tudi3 → 3na2SW4 + Na2S5
- Prav tako se razgradi, ko se zdravi z razredčenimi kislinami, da daje žveplo in žveplov dioksid (imenovan ura reakcije):
Na2S2Tudi3 + 2HCl → 2nacl + s + tako2 + H₂o
- Stoihiometrično reagira (v ekvimolarnih količinah) z vodnimi raztopinami joda, zato se pogosto uporablja v laboratorijih za stopnje na osnovi joda.
Reaktivnost in nevarnosti
Natrijev tiosulfat ni strupen material in se uporablja za medicinske namene. Vendar, ko se razpade, proizvaja strupene hlape žveplovega oksida, kar lahko povzroči draženje v očeh, koži in sluznici.
Spojina lahko draži oči, kožo in dihalne trakte. Snov je strupena za pljuča in sluznice. Ponavljajoča se ali dolgotrajna izpostavljenost snovi lahko povzroči škodo na teh organih.
Če spojina pride v stik z očmi, je treba kontaktne leče preveriti in odstraniti, če jih nosite. Oči z veliko vode je treba takoj oprati vsaj 15 minut s hladno vodo.
V primeru stika s kožo je treba prizadeto območje vsaj 15 minut izpeljati takoj, medtem ko se onesnažena oblačila in čevlji odstranijo.
Kožo morate pokriti z razdraženo. Operite oblačila in čevlje, preden jih spet uporabite. Če je stik resen, operemo z razkužilnim milom in pokrijte kožo, onesnaženo z antibakterijsko kremo.
Vam lahko služi: kisik: lastnosti, struktura, tveganja, uporabeV primeru vdihavanja je treba žrtev prenesti na sveže mesto. Če ne dihate, se daje umetno dihanje. Če je dihanje težko, je treba zagotoviti kisik.
Če se spojina zaužije, bruhanje ne bi smeli sprožiti, razen če ga medicinsko osebje označi. Odvijte tesna oblačila, kot so vrat srajce, pas ali kravata.
V vseh primerih je treba pridobiti takojšnjo zdravstveno oskrbo.
Prijave
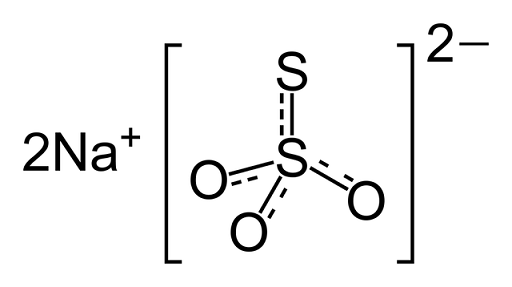 Kemična struktura natrijevega tiosulfata
Kemična struktura natrijevega tiosulfata Zdravilo
- Natrijev tiosulfat se lahko uporabi za zmanjšanje nekaterih stranskih učinkov cisplatina (zdravila za raka).
- Uporablja se pri obvladovanju ekstravazacije med kemoterapijo. Natrijev tiosulfat preprečuje alkilacijo in uničenje tkiva, kar zagotavlja substrat za najeta sredstva, ki so napadli podkožna tkiva.
- Uporablja se tudi z drugim zdravilom pri nujnem zdravljenju zastrupitve s cianidom.
Pri tem zdravljenju intravensko vbrizgamo natrijev nitrit, da nastane hemoglobin, ki je v kombinaciji s cianidnim ionom, in ga začasno spremenimo v obliko cianemetoglobina. Kasneje se vbrizga natrijev tiosulfat.
- Služi kot substrat za encim Rodanasa, ki katalizira pretvorbo cianida v veliko manj strupeno tiocianat, ki se izloči v urin.
- Uporablja se tudi kot zdravljenje kalcifilaksa pri ljudeh v hemodializi s terminalno ledvično boleznijo. Očitno ni popolnoma razumljenega pojava, pri čemer to pri nekaterih bolnikih povzroči hudo presnovno acidozo.
Jodometrija
- Natrijev tiosulfat stehiometrično reagira z jodom, da daje jodid v skladu z reakcijo:
Vam lahko služi: ketoni: vrste, lastnosti, nomenklatura, uporabe, primeri2. mesto2S2Tudi3 + I2 → s4Tudi62− + 2i-
Ta lastnost naredi spojino kot naslov pri določanju joda.
- Ta posebna uporaba je mogoče vzpostaviti za merjenje vsebnosti kisika v vodi z dolgim nizom reakcij v preskusu z raztopljenim kisikom.
- Uporablja se tudi pri volumetrični oceni koncentracij nekaterih spojin v raztopini (na primer vodikov peroksid) in pri oceni vsebnosti klora v komercialnem belilnem prahu in vodi.
Vode vode
- Natrijev tiosulfat se uporablja za razkritje vode, vključno z znižanjem ravni klora za uporabo v akvarijih in bazenih in zdraviliščih ter znotraj čistilnih naprav za čiščenje vode, ki je bila ustanovljena pred sproščanjem v rekah.
Reakcija redukcije je analogna reakciji redukcije joda, tiosulfat zmanjša hipoklorit (aktivna sestavina v belilu) in s tem oksidira na sulfat. Popolna reakcija je:
4naclo + na2S2Tudi3 + 2naOH → 4Nacl + 2na2SW4 + H2Tudi
Ekstrakcija zlata
Natrijev tiosulfat je sestavni del, ki se uporablja kot alternativno sredstvo za izpiranje za cianid za ekstrakcijo zlata. Vendar tvori močan topen kompleks z zlatimi ioni (i), [au (s2Tudi3)2]3-.
Prednost tega pristopa je, da tiosulfat v bistvu ni strupen in da lahko vrste mineralov, ki so ognjevzdržne do zlate ciracije.
Reference
- HSDB: natrijev tiosulfat. Obnovljen od Toxneta.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Varnostni podatkovni list natrij tiosulfat brezvoden material. Okrevano iz Sciencelaba.com.

