Tiole
- 1642
- 86
- Raymond Moen
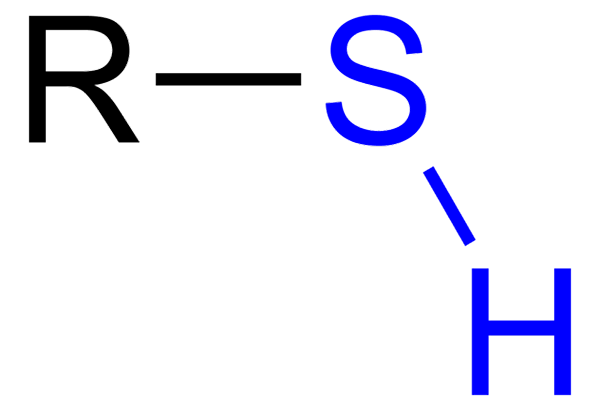
The Tiole So organske spojine, ki imajo skupino SH, imenovano tiol ali sulfihydrilo Group. Njegova splošna formula je RSH, saj lahko predstavlja R za najemnino, arilno ali drugo kemično skupino. Značilna značilnost tiolov je njen močan smrdljiv vonj.
Nekateri tioli se uporabljajo za dajanje vonja po gorljivih plinih, da bi zaznali puščanje teh plinov, kar je glede na njihovo značilnost lahko velike nevarnosti. Tioles so podobni alkoholom, saj imajo skupino OH, tioli.
 Tiol z modro skupino Sulfhydrillo
Tiol z modro skupino Sulfhydrillo Vendar pa imajo več razlik: skupina OH je bolj polarna od skupine SH, žveplo pa je manjši atom kot kisik in manj elektronegative.
To določa, da molekule tiolov ne tvorijo vodikove vezi ali vode ali med njimi. Zato je topnost tiolov v vodi nizka, njegova vrelišče pa je nižja kot pri alkoholih z verigo podobnih ogljikov.
Tiole so še posebej koristne in pogoste v biokemičnih sistemih, saj več ustreza biomolekulam, kot je koencim do. Njegova S-H vez je bolj kisla kot O-H, lažja za razbijanje in tudi lažje nadomestiti ali zamenjati druge molekularne fragmente v številnih žveplovih organskih sintezi.
[TOC]
Lastnosti tiolesa
 Smrdeča aroma vznožja je v glavnem sestavljena iz tiolov
Smrdeča aroma vznožja je v glavnem sestavljena iz tiolov Splošnosti
OH skupina alkoholov in skupina SH tioolov imata nabor fizikalnih in kemijskih lastnosti za pripadnost kisiku in žveplom v isto kemično skupino periodične tabele (prek skupine).
Loa tioéters, uniocetals in tioésters, ki so analogni kemičnim spojinam, ki jih tvorijo alkoholi, kot so etri, acetali in estri. Vendar povezave S-H in O-H predstavljajo nekatere razlike, ki se bodo odražale v lastnostih tiolov in alkoholov.
Vonj
Značilnost tiolov z nizko molekulsko maso je njen neprijeten vonj, podoben česna in čebule. Ta vonj je takšnega obsega, da ima človeški vonj prag enega dela tiola za deset milijard delov zraka.
Etanotiol se v zemeljski plin doda kot varnostni ukrep, da bi zaznali kakršen koli vnetljiv, vendar sam pobeg na stranišču. Vonj tiolov se zmanjšuje s povečanjem števila ogljika njihove verige, ker se nestanovitnost in delež tiolskega žvepla zmanjšuje.
Vam lahko služi: amonijev fosfat: struktura, lastnosti, pridobivanje, uporabeVrelišča in topnost
S-h povezava tiolov ima dipolski trenutek manj kot O-H povezava alkoholov. Poleg tega je atom žvepla manjši in manjši elektronegativnost kot atom kisika.
To določa, da molekule tiolov ne morejo tvoriti vodikovih vezi z vodo ali med njimi, kar povzroči razliko med fizikalnimi lastnostmi tiolov in alkoholov. Na primer: metanotiol (CHO3Sh) ima vrelišče 6 ° C, metanol (CHO3Oh) vre pri 65 ° C.
Zato je pri sobni temperaturi (25 ° C) metanol tekoč in metanotiol je plin.
Če povzamemo: tiole imajo nižjo vrelišče kot ustrezni alkoholi. Iz istih razlogov je topnost tiolov v vodi in v drugih polarnih topilih zelo nizka. Medtem so alkoholi z nizko molekulsko maso zelo topni v vodi.
Reaktivnost
Povezava S-H je šibkejša od vezi O-H, zato Link S-H lažje disociira, zaradi česar so tioli močne kisline kot alkoholi. Večina alkoholov ima PKA med 16 in 18, medtem ko imajo tioli PKA okoli 11.
To omogoča tiole-): Zelo močno nukleofilno sredstvo.
SHIR SHON lahko oksidira, da tvori disulfidne povezave (-s-s-), ki so prisotne v glutationski oksidaciji: tiol, ki je prisoten v celicah in ima antioksidantno funkcijo.
Bromo ali drugi halogeni, pa tudi kisik, lahko delujejo na tiolu, da tvorijo disulfur mostove:
2 RSH +BR → R-S-S-R '+2 HBR
RSSR 'spojine so znane kot organski sulfidi in alkiile, r2S.
Po drugi strani lahko močna oksidacijska sredstva, kot sta natrijev hipoklorit in vodikov peroksid, delujejo na tiole, da povzročijo sulfonske kisline:
Rsh +h2Tudi2 → RSO3H +3 h2Tudi
Nomenklatura
Nomenklatura IUPAC za tiole je zelo podobna imenu alkoholov: ime alkana, iz katerega mu je dodana pripona 'tiol'.
Tako se na primer tistan, pridobljen s stanojem, imenuje 1-butanotiol, ch3Pogl2Pogl2Pogl2SH, ki kaže na številko položaj skupine SH v ogljikih verige.
Vam lahko služi: kation: trening, razlike z anionom in primeriNa enak način je spet še ena nomenklatura, podobna alkoholi. Na primer CHO3Sh, analog metilnemu alkoholu, ch3Oh, se imenuje metil ali merkaptan Mercaptan.
Drug primer bi bil CHO3Pogl2Ch (sh) ch3, imenovan 2-butanotiol, trgovec s sekbutilom ali blagom Secbutil. To pomeni, da je poudarek na identiteti R v formuli RSH. Zato so za tiole izpolnjene tudi druge norme nomenklature za alkohole.
In končno, ko je skupina SH prisotna v večji strukturi ali kjer prevladujejo najpomembnejše skupine, se uporablja predpona sulfihydrilo ali merkapto.
Na primer, spojina ch3Pogl2Ch (sh) coch3 Imenuje se 3-merkapto-2-penona. Upoštevajte, da ima SH manj prednostne naloge kot oksigenirane skupine (razen etra), zato mu manjše številke ustrezajo.
Sinteza
Metoda sinteze tiolov je sestavljena iz reakcije tiote z alkil halogenidom, ki proizvaja vmesno sol izotiorona. To hidrolizira z natrijevim hidroksidom, da dobimo tiol in sečnino.
Pogl3SH se pripravi industrijsko z reakcijo vodikovega sulfida z metanolom v prisotnosti kislinskih katalizatorjev:
Pogl3OH +H2S → ch3Sh +h2Tudi
V drugi proizvodni metodi reagiramo alkil halogenid z natrijevim hidrosulfurom:
RX +NASH → RSH +NAX
Prijave
Pritrditev encimov, povezana z nanodelci
Tiole se uporabljajo kot mostovi za združevanje kompleksov nanoparticula-encim v zlate elektrode. Na primer, tioli se uporabljajo za fiksacijo kompleksa nanodelcev-Uricasa, encima, ki posega v pretvorbo sečne kisline v Allantoine.
Tiol -no reakcija
Gre za organsko reakcijo med tiol in alkenom, ki kliče reakcijo "klik"; Da je med drugimi značilnostmi reakcija visoko zmogljivosti, široko področje uporabe, ki ustvarja odprave s proizvodi z nekromatografskimi metodami, prav tako pa je enostavno izvesti.
Thiol -no reakcija ima aplikacije v sintezi tioazúcarja: sladkor, ki je prisoten v salicinolu, zaviralec α -glikozidaze. Salicinol je bil izoliran iz rastlin, ki se uporabljajo na Šrilanki in Indiji pri zdravljenju sladkorne bolezni.
Poleg tega se tiol -ne reakcija uporablja pri kemiji ogljikovih hidratov, polimerizacij, površinske kemije, kemije sinteze in kemiji peptidov.
Vam lahko služi: zamrzovalna točka: kako jo izračunati in primereVonja
 Kuhinjski plin je stranišče, toda zaradi sestave tiolov z nizko molekulsko maso ima značilen vonj
Kuhinjski plin je stranišče, toda zaradi sestave tiolov z nizko molekulsko maso ima značilen vonj Alifatski tioli z nizko molekulsko maso so vgrajeni v zemeljske pline, tako da njihov močan vonj služi kot opozorilo ob pobegu ali uhajanju plina.
Zdravilo
Penicilamin (c5HenajstNe2S) To je zdravilo, ki se uporablja pri zdravljenju Wilsonove bolezni in revmatoidnega artritisa.
In kaptopril (c9HpetnajstNe3S) se po drugi strani uporablja pri zdravljenju arterijske hipertenzije in pri kongestivnih srčnih boleznih.
Oba sta primeri tiolov z zdravilnimi aplikacijami.
Biološko
Skupine Tioles so med drugimi spojinami z biološko funkcijo, v cisteinu, koencimu A in glutationu.
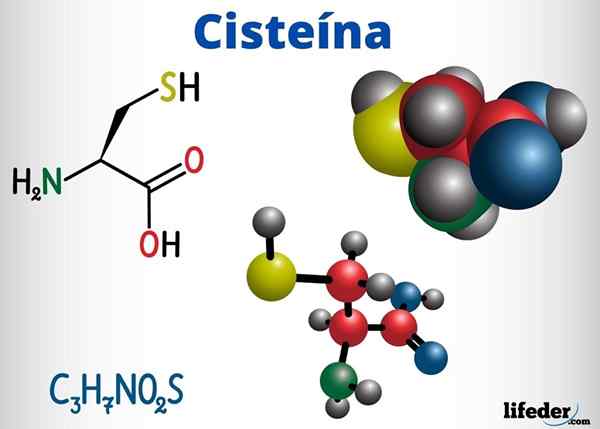
Cistein je aminokislina, ki lahko v svoji beljakovinski verigi tvori disulfurne mostove, zato odgovoren za terciarno strukturo beljakovin. Prav tako lahko tvori disulfumne mostove med različnimi beljakovinskimi verigami, kar povzroči kvartarno strukturo beljakovin.
Cistein se nahaja v aktivnih središčih številnih encimov in ima tudi antioksidantno delovanje.
Glutation je zelo pomembno antioksidativno znotrajcelično delovanje, ki podeljuje zaščito celice in makromolekule, ki ga sestavljajo.
Koencim A je na drugi strani tiol, ki posega v sintezo in oksidacijo maščobnih kislin. Poleg tega koencim v obliki acetilkoencima A vmeša na začetku cikla citronske kisline ali KREBS.
Primeri
Končno bodo nekatera imena tiolov navedena v spremstvu njihovih molekularnih formul:
-Tiocetna kislina (c2H4Ti)
-Koencim a (cenaindvajsetH36N7Tudi16Str3S)
-Zmanjšano glutacijo (c10H17N3Tudi6S)
-Cistein (c3H7Ne2S)
-Mercaptanol (c2H6Ti)
-Metanotiol (pogl3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofenol ali tiomerosal (c6H6S)
-Pomelo Mercaptano (c10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicilamin (c6HenajstNe2S)
-Kaptopril (c9HpetnajstNe3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-Α-lipoičen ali lipoamid (c8H14Tudi2S2). Je ciklični disulfid.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Tiol. Pridobljeno iz: v.Wikipedija.org
- Doktor. Dietmar Kennepohl et al. (13. septembra 2020). Tioli in sulfidi. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Uredniki Enyclopeedia Britannica. (2020). Tiol. Okrevano od: Britannica.com
- Nolan MD in Scanlan EM (2020) Uporaba tiol-ene kemije za peptidno znanost. Fronta. Kem. 8: 583272. Doi: 10.3389/FCHEM.2020.583272
- Doktor. Carl c. Wamser. (1999). 9. poglavje: Alkoholi in tioli. Pridobljeno iz: splet.PDX.Edu

