Molekularna orbitalna teorija

- 5098
- 1502
- Roman Schamberger
Kaj je molekularna orbitalna teorija?
The Molekularna orbitalna teorija (Tom) To je matematični model, razvit za razlago fizikalno -kemijskih lastnosti molekul, kot so absorpcija in oddajanje sevanja, električna prevodnost, pa tudi elektronska narava njegovih povezav. To meni, da so za razliko od teorije povezav Valencia (TEV) elektroni premeščeni po celotni molekuli, ne da bi bili verjetnostni v povezavah.
Zato molekularna orbitalna teorija uporablja enaka kvantna načela, ki narekujejo valovne funkcije za atomske orbitale in tako opisujejo energijsko stanje elektronov v atomih; Šele zdaj naslavlja tako imenovane molekularne orbitale, ki izvirajo iz linearnih kombinacij atomskih orbitalov atomov, ki so povezani.
 Paramagnetizem tekočega kisika in s tem njena privlačnost za magnete je razložen zaradi molekularne orbitalne teorije. Vir: Pieter Kuipeper prek Wikipedije.
Paramagnetizem tekočega kisika in s tem njena privlačnost za magnete je razložen zaradi molekularne orbitalne teorije. Vir: Pieter Kuipeper prek Wikipedije. Nato deluje molekularna orbitalna teorija, ki deluje z molekularnimi orbitali, njihovimi elektronskimi in prostorskimi porazdelitvami ter diagrami njihovih energij, ki omogočajo opazovanje energijskih vrzeli, ki jih ločijo. Predvsem pojasnjuje paramagnetizem nekaterih snovi, kot je molekularni kisik v tekočem stanju (glej zgoraj).
O2, Opisala Lewisove strukture in Valencia -jeva teorija povezav ima vse svoje seznanjene elektrone, zato bi teoretično moralo biti diamagnetno. Vendar se je v praksi pokazalo, da je pravzaprav paramagnetno, torej manjka elektrone; posebej par manjkajočih elektronov.
Iz konstrukcije OM diagrama (molekularne orbitale) za O2, Homonuklearna diatomična molekula je razvidno, da bosta dejansko manjkajoči elektroni z visoko energijo. Ne samo to, ampak tudi vrtenje in položaj teh elektronov v OMS pojasnjuje tudi druga elektronska stanja ali2 (Single).
Druge najpomembnejše zmage molekularne orbitalne teorije je, da pomaga napovedati možni obstoj diatomskih molekul, pa tudi njihovo relativno stabilnost. Tako je molekularna orbitalna teorija prava pri napovedovanju molekul, kot je B2 in li2, tudi kadar lahko v fazi pare zaznajo le pri visokih temperaturah. Tudi ta teorija zavrača obstoj hipotetike, ki jo imam2 ali NE2.
Vrste molekulskih vezi in orbitale
Tako kot pri teoriji povezav Valencia, je tudi v molekularni orbitalni teoriji upoštevano več vrst povezav, odvisno od usmeritve prekrivanja atomskih orbitalov, ki sodelujejo v kemični vezi. Med najpomembnejšimi in prisotnimi v molekularni naravi imamo vezi Sigma in Pi.
Sigma
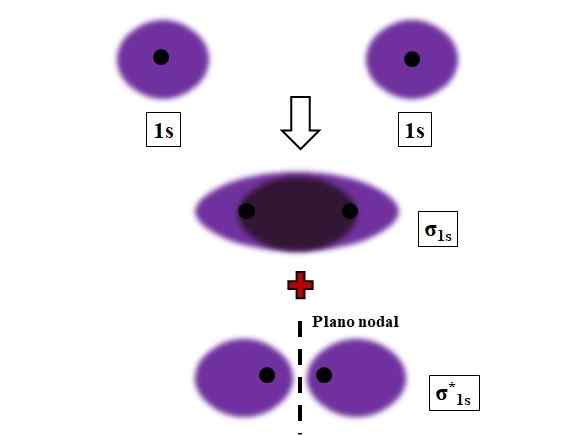 Oblikovanje σ1s in σ1s* povezav med prekrivanjem dveh atomskih orbitalov 1s. Vir: Gabriel Bolívar.
Oblikovanje σ1s in σ1s* povezav med prekrivanjem dveh atomskih orbitalov 1s. Vir: Gabriel Bolívar. Sigma, σ vezi se vzpostavijo, ko se atomske orbitale prekrivajo frontalno, glede na namišljeno sekironuklearno sekiro.
Razmislite, na primer povezava σ, ki se tvori, ko sta dve atomski orbitali 1s, glede na vodikov atom, blizu zelo kratke razdalje (slika zgoraj). Ker so 1S orbitale simetrične, bo njihovo prekrivanje vedno čelno; Zato bodo vedno ustvarili molekularne orbitale σ1s in σ1s*.
Upoštevajte, da je molekularna orbitalna σ1s prikazuje elektronsko gostoto, koncentrirano v prostoru, ki ločuje obe jedri. To pomeni, da v orbitalu σ1s Verjetnost iskanja elektrona je največja v tem območju molekule. Elektroni σ1s Preselijo se po celotnem prostoru, ki pokriva vijolično barvo.
Po drugi strani pa v orbitalu σ1s* Med obema jedro imamo vozliško ravnino. To pomeni, da je verjetnost iskanja elektrona med tem prostorom enaka nič. Upoštevajte, da v orbitalu σ1s* Elektroni opisujejo položaje okoli vsakega od obeh jeder; ne okoli molekule kot celote.
Vam lahko služi: radio: struktura, lastnosti, uporabe, pridobivanjePi
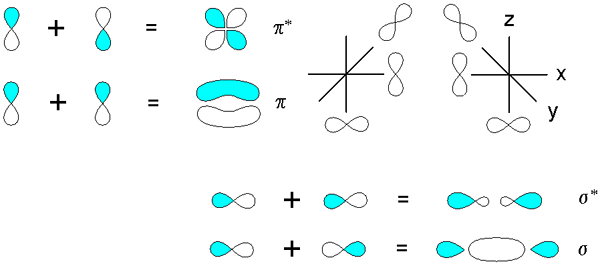 Sigma in pi vezi, ki izhajajo iz prekrivanja orbital p. Vir: v8rik v in.Wikipedia, cc by-sa 3.0, prek Wikimedia Commons
Sigma in pi vezi, ki izhajajo iz prekrivanja orbital p. Vir: v8rik v in.Wikipedia, cc by-sa 3.0, prek Wikimedia Commons Razmislite zdaj o molekularni vezi in orbitali. Te se pojavijo, ko se prekrivanje orbital zgodi v smeri, pravokotno na osi internuklearne osi, ki je samovoljno pritrjena v kateri koli osi kartezijanske ravnine. Ob predpostavki, da govorimo o orbitalu 2px, 2P orbitalin Prosto lahko vzpostavimo povezavo (glej modro -bele režnje).
Ko dve orbitali 2pin Izvirata dve molekularni orbitali: π2Py in π2Py*; Prva ima najvišjo elektronsko gostoto in pod internuklearno osi, druga.
Po drugi strani pa orbitale 2p, če rečem 2px, Prav tako se lahko prekrivajo frontalno, da nastanejo σ vez in dve molekularni orbitali σ2px in σ2px*. Kot v primerih σ1s in σ1s*, Orbital σ2px kaže večjo elektronsko gostoto med obema jedrima; ki je v nasprotju z σ2px*, kjer so elektroni usmerjeni proti strani zunaj.
Povezava
Molekularne orbitale Linding so tiste, ki prispevajo k stabilnosti molekule. To pomeni, da morajo imeti manj energije v primerjavi z atomskimi orbitali posameznih atomov, preden povežejo in tvorijo molekulo. V teh orbitalih se elektroni preselijo z vsemi dimenzijami molekule kot celote.
V diagramih OM bodo vedno nameščeni pod atomskimi orbitali, ki so se združile, da bi jih oblikovale. To bomo podrobneje videli v naslednjih razdelkih.
Anti -hot
Molekularne orbitale proti dohodniku so na drugi strani tiste, ki destabilizirajo molekulo. Simbolizirajo jih z zvezdico (*), njihove energije pa so večje od energije atomskih orbital, ki so jih izvirale. V teh orbitalih se elektroni preselijo precej nepravilno, kot da je molekula elektronsko razdrobljena.
V OM diagramih bodo vedno nameščeni nad atomskimi orbitali, ki so se združile, da bi jih oblikovale.
Ni povezan
Medtem so orbitale, ki ne vežejo, in njihovi elektroni, tiste, ki ne prispevajo ali škodijo stabilnosti molekule. Njegove energije so zelo podobne energijam atomskih orbitalov.
Naročilo povezave
Vrstni red povezave postane v teoriji molekularne orbitale, prav tako tudi številka povezave je v teoriji povezav Valencia: merilo sile povezave v molekuli. Tako vrstni red povezave, ki je enak 1, ustreza preprosti povezavi (-). In naročilo povezave (oz.e) Enako 2, ustreza dvojni vezi (=). Torej naprej.
Ta vrstni red je določen iz štetja elektronov v diagramih OM za določeno molekulo. Če želite to narediti, je treba uporabiti naslednjo formulo:
tudi.E = (Število povezanih elektronov - Število proti -uhit elektronov)/2
Povezava elektroni prispevajo k molekuli za stabilizacijo, medtem ko jo protifirni elektroni destabilizirajo. Zato je bolj proti -sung elektroni, manjši je oz.E, in molekula bo ponavadi zelo nestabilna. Ko je O.E je enak 0, pomeni, da molekula ne obstaja (ali vsaj teoretično).
OM diagrami
V OM diagramih so predstavljene energije molekulskih orbitalov, vizualizirana pa je tudi njegovo elektronsko polnjenje, ki upošteva pravila Aufbaufa in Sinna, pa tudi načelo izključitve Pauling. Razmislite na primer naslednja dva diagrama:
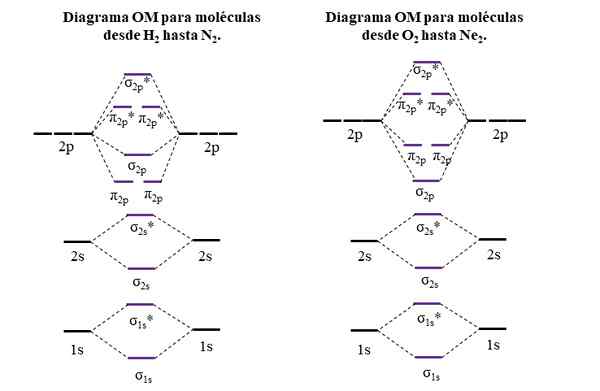 OM diagrami za molekule prvega in drugega obdobja periodične tabele. Vir: Gabriel Bolívar.
OM diagrami za molekule prvega in drugega obdobja periodične tabele. Vir: Gabriel Bolívar. Vodoravne črte na straneh, črne, predstavljajo energijo atomskih orbital. Namesto tega so osrednje vodoravne črte, vijolične, energije molekularnih orbital. Upoštevajte, kako se porazdelijo povezave in anti -agentske OMS (*) glede na atomske orbitale posameznih atomov.
Lahko vam služi: amino skupina (NH2): struktura, lastnosti, primeriUpoštevajte tudi, da v desnem diagramu OM σ2 p Menjajo mesto z π2 p. To se zgodi z molekulami O2, F2, in hipotetično NE2.
Primeri
V naslednjih primerih bo OM nadaljeval z elektroni, izračunal vrstni red povezave in napovedal silo vezi ali stabilnost zadevne molekule.
H2
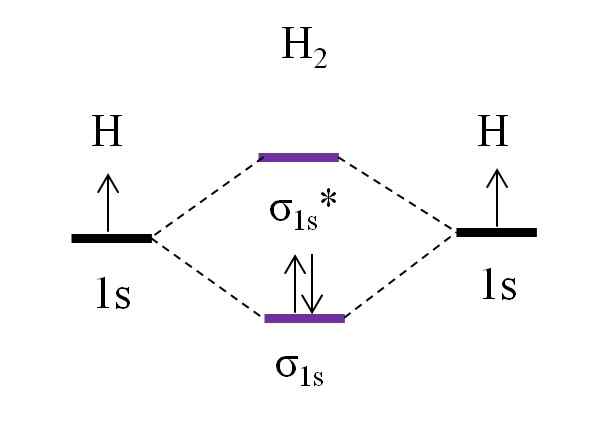 OM diagram za molekulo dihidrogena. Vir: Gabriel Bolívar.
OM diagram za molekulo dihidrogena. Vir: Gabriel Bolívar. Začenši z najpreprostejšo molekulo, dihidrogen, h2, Dva H atoma sta povezana s kombiniranjem dveh 1S atomskih orbitalov, da tvorita dve molekularni orbitali σ1s in σ1s*. Oba elektrona nato zapolnita molekularne orbitale.
Najprej je orbitalna σ zapolnjena1s, Ker je najmanj energija (pravilo Aufbauf). Nato mora drugi elektron dokončati izpolnitev orbitala σ1s Preden se povzpnete na orbitalno σ1s* (Pravilo umivalnika). In končno ta drugi elektron vodi vrtenje v nasprotni smeri do prvega elektrona (načelo izključitve Pauling). Tako sta oba elektrona nameščena v povezani orbitali σ1s.
Kaj pa vrstni red povezave? V povezavi molekularna orbitalna σ1s Imamo 2 elektrona; Medtem ko je v proti -no -nosilci molekularni orbital σ1s* Nimamo nobenega. Zato bi bil izračun:
tudi.E = (2-0)/2
= 1
Biti oz.In enako 1, to pomeni, da je povezava, ki združuje oba atoma vodika, preprosta: H-H. Na splošno, če je ta vrednost enaka ali večja od 1, pravijo, da molekula obstaja in je stabilna.
On2
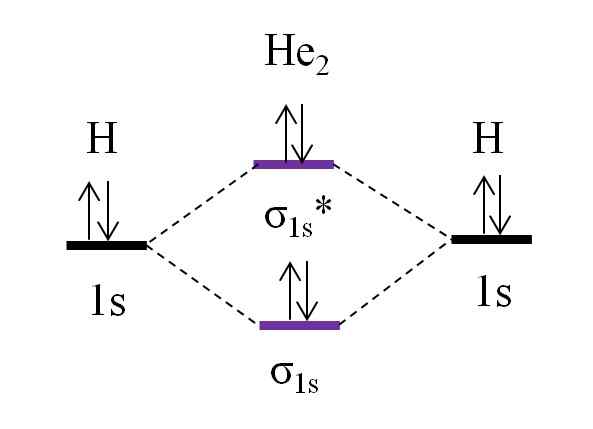 OM diagram za hipotetično molekulo Dihelio. Vir: Gabriel Bolívar.
OM diagram za hipotetično molekulo Dihelio. Vir: Gabriel Bolívar. Zdaj predpostavimo, da imate molekulo on2. Zgoraj vidimo, da je njegov diagram OM zelo podoben H2, Z dvema dodatnima elektronoma, ki se nahajata v orbitalu σ1s*. Kadar je skupno 4 elektrona, ki dodajo oba atoma, potem morajo biti tudi 4 elektroni v vseh nastalih molekularnih orbitalih.
Določitev o.E za i he2 bomo imeli:
tudi.E = (2-2)/2
= 0
To pomeni, da ni možne povezave, da dva atoma helija. Dejansko do danes ni bil ugotovljen obstoj te molekule, kar se strinja z napovedmi molekularne orbitalne teorije.
B2
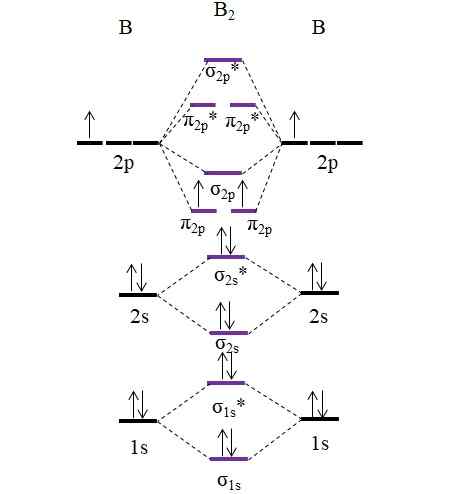 OM diagram za molekulo B2. Vir: Gabriel Bolívar.
OM diagram za molekulo B2. Vir: Gabriel Bolívar. Upoštevajte, da se pri tvorbi molekulskih orbitalov upoštevajo tudi elektroni notranjih plasti; Ne samo tisti iz Valencije.
Tako v primeru diboro molekule, b2, Vsak atom bora prispeva 5 elektronov, od tega 3 iz Valencije; To so tisti, ki so njihovi 2S in 2p orbitali. Dva elektrona orbital 2p sta nameščena v različnih molekulskih orbitalih π2 p Z vzporednimi bodicami (pravilo umivalnika).
Nato nadaljujemo z izračunom naročilo povezave:
tudi.E = (6-4)/2
= 1
Zato se pričakuje, da bo molekula imela preprosto povezavo B-B. B2 To je molekula, ki v fazi pare obstaja le pri zelo visokih temperaturah, saj boro v normalnih pogojih sprejema bolj zapletene mrežne strukture in modele.
C2 in c22-
Najprej razmislite o OM diagramu za molekulo c2:
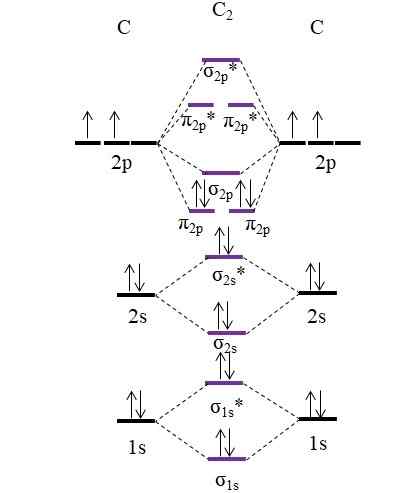 OM diagram za molekulo C2. Vir: Gabriel Bolívar.
OM diagram za molekulo C2. Vir: Gabriel Bolívar. Zdaj sta dva nova elektrona, ki jih zagotavljata ogljikovi atomi, ponovno nameščena v molekularni orbitali π2 p Toda z nasprotnimi vrtljaji (načelo izključitve Paulinga).
Določitev naročila povezave bomo imeli:
tudi.E = (8-4)/2
= 2
Upoštevajte, da so molekularne orbitale π2 p V formulo dodajte 4 elektrone. Ker je ta naročilo enako 2, to pomeni, da molekula c2 Ima dvojno vez, c = c. Spet molekula c2, Imenovan tudi diatomični ogljik, pri visokih temperaturah je samo faza pare in je ena najpreprostejših alotropnih oblik ogljika.
Kaj pa c22-? Vaš diagram OM je naslednji:
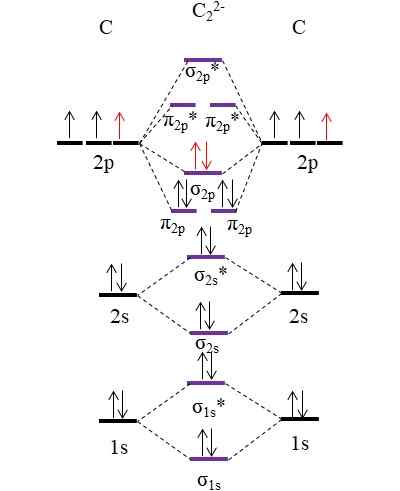 OM Diagram za Anion C22-. Vir: Gabriel Bolívar.
OM Diagram za Anion C22-. Vir: Gabriel Bolívar. Dva nova elektrona (rdeče puščice) sta nameščena v povezavi molekularni orbitali σ2 p. To torej domneva, da vsak atom ogljika prispeva eno od obeh negativnih nabojev (za stanje oksidacije -1).
Vam lahko služi: živo srebro: struktura, lastnosti, pridobivanje, uporabeIzračun vašega vrstnega reda bomo imeli:
tudi.E = (10-4)/2
= 3
To je anion c22-, Imenovan tudi Anion acetiluro, ima trojno povezavo, [C≡C]2-. Je relativno stabilen anion z odlično povezavo; Vendar pa lahko odvisno od svojih nasprotnih ionov izvira eksplozivne spojine.
N2 in n2+
Znana molekula dušika, n2, Odlično ga je mogoče opisati tudi z uporabo molekularnih orbitalnih diagramov:
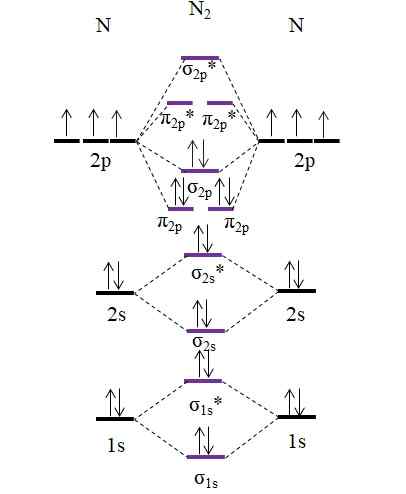 OM diagram za molekulo N2. Vir: Gabriel Bolívar.
OM diagram za molekulo N2. Vir: Gabriel Bolívar. Upoštevajte, da je ta diagram popolnoma enak kot za Anion C22-. To pomeni, da n2 in c22- So izolektronski. Vendar takšno dejstvo ne pomeni, da se obe vrsti obnašata na enak način. N2, nevtralen, je veliko bolj stabilen kot c22-, negativno, tudi če imata oba vrstni red povezave, ki je enak 3, n≡n.
Kaj pa kation n2+? Poglejmo vaš diagram OM:
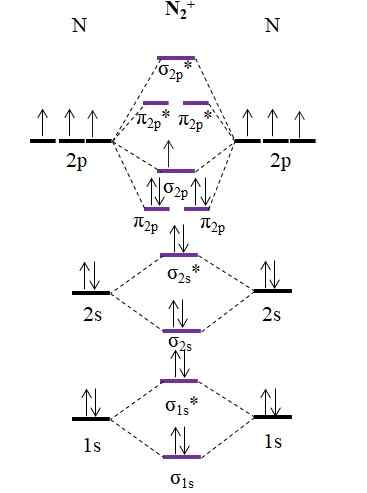 OM Diagram za kation N2+. Vir: Gabriel Bolívar.
OM Diagram za kation N2+. Vir: Gabriel Bolívar. Kot kation n2+ Ima en manj elektron, ta se odstrani molekularna orbitala σ2 p. N2 Je diamagnetno, medtem ko je n2+ Je paramagnetna. In njegovo naročilo je:
tudi.E = (9-4)/2
= 2.5
Povezava 2 2.5 bi bilo predstavljeno z dvema vrsticama in eno točko. Vendar pa v Valenciji ali v Lewisovih strukturah nima veliko smisla. Ker je ta vrstni red povezave manj kot 3, je sila povezave, prisotna v N2+ je nižji od n2, Torej je bolj nestabilno.
Tudi2, Tudi22- jaz22+
Zdaj si oglejmo še eno zelo pomembno molekulo za življenje: molekularni ali diatomski kisik ali2. Po Valenciji teorije in Lewisovih strukturah bi morala biti diamagnetna; Toda eksperimentalno se je izkazalo za paramagnetno, zato je nekje izginil elektrone.
Spodaj primerjamo diagrame OM za O2 in ioni oz22- (oksid) in o22+ (Oksidacija):
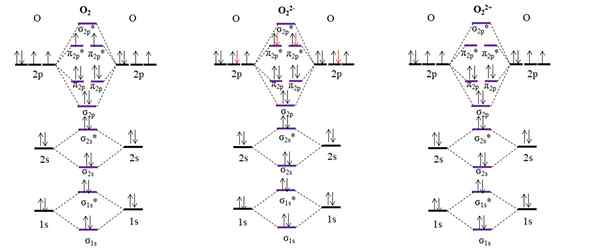 OM diagrami za molekularni kisik in dva glavna iona. Vir: Gabriel Bolívar.
OM diagrami za molekularni kisik in dva glavna iona. Vir: Gabriel Bolívar. Diagram OM za o2 Vzorec, za razliko od prejšnjih, da molekulske orbitale σ2 p in π2 p Spremenite njihov energetski položaj. Prav tako učinkovito vidimo, da sta v orbitalah π manjkajoča elektrona2 p*, ki pojasnjuje paramagnetni značaj kisika (omenjen na začetku članka).
Po drugi strani imamo tudi diagram OM za anion oz22-, Neskončno razširjeno v kozmosu (lune, planeti, kometi, asteroidi itd.). Ima dva dodatna elektrona (rdeče puščice), ki zaključujeta π orbitale2 p*, parjenje vseh elektronov. Posledično ali22- Je diamagnetno.
Upoštevamo tudi diagram OM za oksidacijo oz22+. Ima dva elektrona manj kot O2, puščanje praznih orbital π2 p*. Vsi njegovi elektroni so seznanjeni in zato je diamagnetni.
Povezava naročila za O2, Tudi22- jaz22+ So: 2 (o = o), 1 [o-o]2- in 3 [O≡O]2+. Zato je O22+ bi imel najmočnejšo povezavo.
Prednosti in slabosti
Prednosti
Med prednosti molekularne orbitalne teorije lahko navajamo naslednje:
-Omogoča oceno naročil povezav, da navadne v teoriji povezav Valencia ne bi imele veliko smisla
-Dobro je povezan z diamagnetizmom in paramagnetizmom molekul
-Razdalja, ki ločuje molekularne orbitale v diagramih, je enaka ΔE in služi za razlago elektronskih prehodov produkt absorpcije fotona
-Ne velja samo za homonuklearne diatomske molekule, ampak tudi za heteronuklearne molekule, kot je CO2 in benzen
-Svoj model razširja na druge vrste spojin, kot so anorganski kompleksi, zato podpira teorijo polja ligandov
-Upoštevanje, da se elektroni preselijo po celotni molekuli, je primerno razložiti številne fizikalno -kemijske lastnosti
Slabosti
In med nekaterimi pomanjkljivostmi molekularne orbitalne teorije, ki jih imamo, se moramo končati:
-Je zelo abstrakten in zahteva globoko matematično razumevanje, da ga v celoti razume
-Diagrami molekulacije kot co2, Co, h2Ali in druge, so lahko preveč dolgočasni, da bi ga lahko pojasnili in razložili
-Nič ne pravi o določenih regijah ali povezavah velike molekule
-Prav tako ne daje nobenih informacij o molekularni geometriji (trigonalna ravnina, kvadratna ravnina, tetraedra itd.).
-Ni tako grafična kot teorija povezav Valencia
Molekularna orbitalna teorija, v zaključku.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Orbitalna molekularna teorija. Pridobljeno iz: v.Wikipedija.org
- Stephen nižji. (7. septembra 2020). Orbitalna molekularna teorija. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Steven a. Hardinger. (2017). Orbitalna molekularna teorija. Pridobljeno od: chemed.Kem.Purdue.Edu
- Tiskovnice. (s.F.). Poglavje 8: Orbitalna molekularna teorija. Pridobljeno iz: OpenTextbc.AC

