Dobavljajo različne značilnosti, strukturo, funkcije
- 3267
- 80
- Adrian Legros
The Dismutas superoksid (Sod) bodisi oksidortiran superoksid, V naravi sestavljajo družino vseprisotnih encimov, katerih glavna funkcija je v obrambi aerobnih organizmov proti radikalom brez kisika, zlasti superoksidnih anionskih radikalov.
Reakcija, ki jo ti encimi katalizirajo, se pojavlja praktično v vseh celicah, ki so sposobne dihanja (aerobika) in je bistvenega pomena za njihovo preživetje, saj odpravlja radikalne strupene, brez kisika.
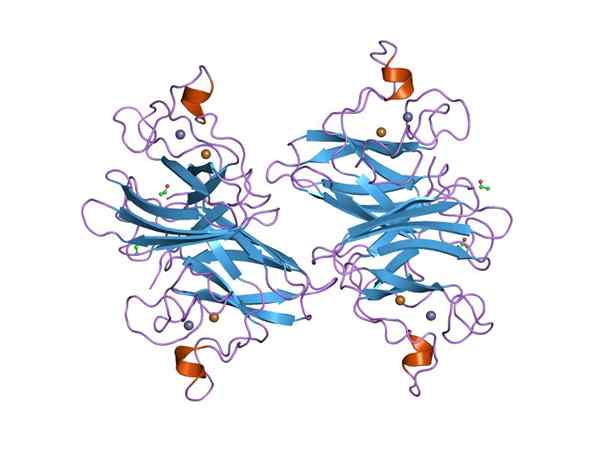
 Grafični prikaz Dymputase Superoxid (SOD) CU-ZN (Vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons)
Grafični prikaz Dymputase Superoxid (SOD) CU-ZN (Vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons) Številne bolezni pri živalih so povezane z kopičenjem različnih reaktivnih kisikovih vrst, enako pa velja za rastline, glede na to, da okolje nalaga številne in konstantne vrste oksidativnega stresa, ki se premaga.
To skupino encimov so leta 1969 odkrili McCord in Fridovich, od takrat.
[TOC]
Značilnosti
Dysmutas superoksid reagira s radikali superksida do resnično visokih stopenj, kar pomeni zelo učinkovito obrambno črto za odstranitev teh molekul.
Pri sesalcih so opisani vsaj tri izoforme za prekomerno dismutazo, znano kot SOD1, SOD2 in SOD3.
Dve od teh izoform imata bakrene in cinkove atome v svojih katalitičnih središčih in se med seboj razlikujejo glede na njihovo lokacijo: znotrajcelični (citosolni, SOD1 ali Cu/Zn-SOD) ali z zunajceličnimi elementi (EC-SOD ali SOD3).
Isoform SOD2 ali MN-SOD, za razliko od prejšnjih dveh, ima atom mangana kot kofaktor in njegova lokacija se zdi omejena na mitohondrije aerobnih celic.
SOD1 izoencimi so predvsem v citosolu, čeprav so bili odkriti tudi v jedrskem oddelku in lizosomih. SOD 3 izoencimi, nasprotno, so opisani v krvni plazmi ljudi, v limfni in možganski tekočini.
Vam lahko služi: kako se sčasoma spreminjajo živa bitja?Vsaka od teh izoform je kodirana z različnimi geni, vendar pripada isti družini, njegova transkripcijska regulacija.
Drugi deminozni superoksid
Dismonični superoksid s katalitičnimi mesti, ki imajo ione bakra in cinka ali mangana, niso edinstveni za sesalce, ti so prisotni tudi v drugih organizmih, ki vključujejo rastline in bakterije različnih razredov.
Obstaja dodatna skupina dismutas superoksida, ki ga pri sesalcih ne najdemo in ki jih je enostavno prepoznati, saj imajo na svojem aktivnem mestu železo namesto katerega koli od predhodno opisanih za druge razrede dismatoznega superoksida.
V In. coli, Dismi nadtroksida, ki vsebuje železo. Ta encim je podoben tistemu, ki ga najdemo v mitohondrijih številnih evkariotov.
Rastline imajo tri vrste encimov: tiste, ki vsebujejo baker in cink (Cu/Zn-sod), ki vsebujejo mangan (Mn-sod) in tiste, ki vsebujejo železo (Fe-sod) v svojem aktivnem središču in v teh organizmih, ki vadijo Analogne funkcije z ne-vegetalnimi encimi.
Reakcija
Encimski substrati z disMy-superoksidom so superoksidni anioni, ki so predstavljeni kot O2- in so posredniške spojine v procesu zmanjšanja kisika.
Reakcijo, ki jo katalizirajo, lahko razmišljamo v splošnih linijah, kot je transformacija (spor) prostih radikalov za tvorbo molekularnega kisika in vodikovega peroksida, ki se sproščajo v okolje ali zaposlene kot substrat iz drugih encimov.
Vam lahko služi: glukani: struktura, značilnosti in funkcijeVodikov peroksid lahko pozneje izločimo iz celic, zahvaljujoč delovanju katerega koli od encimov glutationa, vendar peroksidaze in katalaze, ki izvajajo tudi pomembne funkcije pri zaščiti celic.
Struktura
Ismutas superoksidni izoencimi pri ljudeh se lahko med seboj razlikujejo glede na določene strukturne vidike. Na primer, izoencim SOD1 je 32 kDa molekulske mase, SOD2 in SOD3.
Druga skupina dismatoznega superoksida, Fe-sod, prisoten v rastlinah in drugih organizmih, razen sesalcev, so encimi Dimérrica enakih podenot, to je homodimer.
V nekaterih rastlinah ti Fe-sod vsebuje domnevno N-terminalno signalno zaporedje za transport v notranjosti kloroplastov, drugi pa vsebujejo trikvirno trans-končni zaporedje na peroksisome, zato se domneva, da je njegova podcelična porazdelitev omejena oba predela.
Alfa propelerji in listi, ki so v skladu s.
Funkcije
Dismonični superoksid brani celice, organe in telesna tkiva poškodb, ki jih radikali brez kisika lahko povzročijo, kako lipidno peroksidacijo, denaturacija beljakovin in mutageneza DNK.
Pri živalih lahko te reaktivne vrste povzročijo tudi srčne lezije, pospešijo staranje in sodelujejo pri razvoju vnetnih bolezni.
Rastline zahtevajo tudi bistveno encimsko aktivnost prekomerno oksid dismutaze, saj številni stresni pogoji okolja povečujejo oksidativni stres, to je koncentracija zmerne reaktivne vrste.
Pri ljudeh in drugih sesalcih imajo tri izoforme, opisane za dismutazo nadstroksida, različne funkcije. Na primer, izoencim SOD2 sodeluje pri diferenciaciji celic in tumorogenezi ter tudi pri zaščitni pljučni strupenosti, ki jo povzroča hiperoksija (visoka koncentracija kisika).
Vam lahko služi: Inulin: struktura, lastnosti, hrana, kontraindikacijeZa nekatere vrste patogenih bakterij encimi SOD delujejo kot "virulenčni dejavniki", ki jim omogočajo, da premagajo številne oksidativne stresne ovire, s katerimi se lahko soočijo med invazijskim postopkom.
Sorodne bolezni
Zmanjšanje aktivnosti superoksida dismutaze lahko daje več dejavnikov, tako notranje kot zunanje. Nekateri so povezani z neposrednimi genetskimi okvarami kodiranja genov za Encime SOD, drugi pa so lahko posredni, povezani z izražanjem regulativnih molekul.
Veliko število patoloških stanj ljudi je povezano z encimi SOD, vključno z debelostjo, diabetesom, rakom in drugimi.
Glede raka je bilo ugotovljeno, da obstaja veliko vrst tumorjev raka, ki imajo nizko raven katerega koli od treh superoksida sesalcev (SOD1, SOD2 in SOD3).
Oksidativni stres, ki ga preprečuje aktivnost superoksida dismutaze, je povezan tudi z drugimi patologijami sklepov, kot so osteoartritis, revmatoidni artritis. Mnoge od teh bolezni so povezane z izražanjem dejavnikov, ki zavirajo aktivnost SOD, kot je faktor TNF-α.
Reference
- Fridovich, i. (1973). Swiden dismuta. Annu. Rev. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superoksid dismuti in vpliv na zdravje ljudi. Vidiki molekularne medicine, 26, 340-352.
- Oberley, l. W., & Bueftner, g. R. (1979). Vloga distina superoksida pri raku: pregled. Raziskave raka, 39, 1141-1149.
- Taylor, str., Bowler, c., Kamp, w. Kombi, montagu, m. Van, Inzé, D., & Praženo, k. (2012). Superoksid, razdeljen v rastline. Kritični pregledi v znanosti o rastlinah, 13(3), 37–41.
- ZELKO, i., Mariani, t., & Folz, r. (2002). Superoksid Distam Multigene Family: v primerjavi z genskimi strukturami Cuzn-SOD (SOD1), MN-SOD (SOD2) in EC-SOD (SOD3), evolucije in izražanja. Brezplačna radikalna biologija in medicina, 33(3), 337–349.

