Cinkov sulfid (ZN)
- 2844
- 378
- Adrian Legros
 Cinkov sulfid. Vir: Wikimedia Commons
Cinkov sulfid. Vir: Wikimedia Commons Kaj je cinkov sulfid?
On Cinkov sulfid To je anorganska spojina formule ZnS, ki ga tvorijo kationi Zn2+ in anioni s2-. V naravi ga najdemo predvsem kot dva minerala: wurtzit in spheny (ali cinkova mešanica), pri čemer je slednja njegova glavna oblika.
Sphenhell je predstavljen v črni naravi zaradi nečistoč, ki jo predstavlja. Čisto predstavlja bele kristale, medtem ko ima wurtzita sivkasto bele kristale.
Cinkov sulfid je netopen v vodi. Lahko povzroči škodo v okolju, saj prodira v tla in onesnaži podzemno vodo in njihove tokove.
Med drugimi reakcijami lahko pride do cinkovega sulfida, korozije in nevtralizacije.
S korozijo:
Zn +h2S => ZnS +H2
Z nevtralizacijo:
H2S +Zn (OH)2 => ZNS +2H2Tudi
Cinkov sulfid je fosforescentna sol, ki mu daje zmogljivost več uporabe in aplikacij. Poleg tega gre za polprevodnik in fotokatizacijo.
Cinkova sulfidna struktura
Cinkov sulfid sprejema kristalne strukture, ki jih urejajo elektrostatične znamenitosti med kationom Zn2+ in anion s2-. To sta dva: mešanica spheny ali cinka in Wurzita. V obeh ionih minimizirajo odboj med enakimi ioni.
Cinkova mešanica je najbolj stabilna v kopenskih pogojih tlaka in temperature; In Wurzita, ki je manj gosta, je posledica kristalne reorganizacije zaradi zvišanja temperature.
Obe strukturi lahko hkrati sobivata v istem ZNS trdnem času, čeprav bo Wurzita zelo počasi na koncu pretežno.
Cinkova mešanica
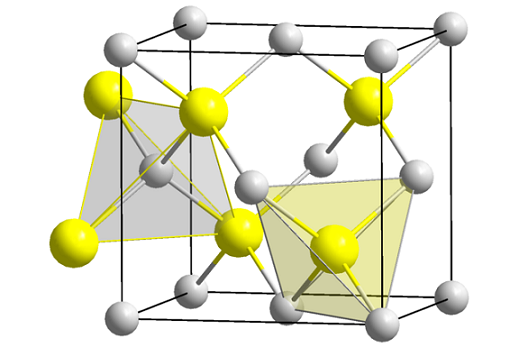
 Struktura mešanice cinka (Spheny). Vir: Wikimedia Commons
Struktura mešanice cinka (Spheny). Vir: Wikimedia Commons Vrhunska slika prikazuje kubično celico, osredotočeno na obraze strukture cinkove mešanice. Rumene kroglice ustrezajo a anionom2-, in sive do kationi2+, Nahaja se v vogalih in v središčih kocke.
Vam lahko služi: Isobutil: nomenklatura, usposabljanje, struktura in značilnostiUpoštevajte tetraedrske geometrije okoli ionov. Cinkova mešanica lahko predstavljajo tudi te tetraedre, katerih luknje v kozarcu imajo isto geometrijo (tetraedrske votle).
Prav tako je delež ZnS izpolnjen znotraj enotnih celic; to je delež 1: 1. Tako za vsako zn kation2+ Obstaja anion s2-. Na sliki se morda zdi, da sive sfere obilujejo, v resnici pa, ko so v vogalih in v središču pesta, jih delijo druge celice.
Na primer, če se vzamejo štiri rumene sfere, ki so znotraj škatle, bi morali "koščki" vseh sivih kroglic naokoli dodati isto (in to storiti), štiri. Tako so v kubični enotni celici štirje Zn2+ in štiri s2-, SNS stehiometrični delež je izpolnjen.
Prav tako je pomembno poudariti, da obstajajo tetraedrske luknje naprej in za rumenimi sferami (prostor, ki jih ločuje drug od drugega).
Wurzita
 Wurzitna struktura. Vir: Wikimedia Commons
Wurzitna struktura. Vir: Wikimedia Commons Za razliko od strukture cinkove mešanice Wurzita sprejme šesterokotni kristalni sistem (vrhunska slika). To je manj kompaktno, zato ima trdna trdna manjša gostota.
Ioni v Wurziti imajo tudi tetraedrska okolja in delež 1: 1, ki se strinja s formulo ZNS.
Lastnosti cinka sulfida
Barva
Lahko ga predstavite na tri načine:
-Wurtzita, belih in šesterokotnih kristalov.
-SphenHell, belo-popravnih kristalov in kubičnih kristalov.
-Kot beli do sivkast ali rumenkasto beli prah in kubični rumenkasti kristali.
Tališče
1.700 ° C.
Topnost vode
Praktično netopno (0,00069 g/100 ml pri 18 ° C).
Topnost
Netopna v alkalijih, topna v razredčenih mineralnih kislinah.
Gostota
Kroglice 4,04 g/cm3 in Wurtzita 4.09 g/cm3.
Trdota
Ima trdoto od 3 do 4 na lestvici MOHS.
Stabilnost
Ko vsebuje vodo, počasi oksidira sulfat. V suhem okolju je stabilen.
Razgradnja
Ko se segreje pri visokih temperaturah, oddaja strupene cink in hlape z žveplovimi oksidi.
Lahko vam služi: natrijev hidrid (NAH): lastnosti, reaktivnost, nevarnosti, uporabeNomenklatura cinkove sulfida
Elektronska konfiguracija Zn je [AR] 3D104s2. Pri izgubi dveh elektronov 4S orbitala je kot Zn kation2+ S svojimi orbitali polnih. Zato je v elektronski obliki Zn2+ Je veliko bolj stabilen kot Zn+, Ima samo valenco +2.
Zato je izpuščen za nomenklaturo zalog in doda svojo valenco, zaprto v oklepajih in z rimskimi številkami: cinkov sulfid (ii).
Sistematične in tradicionalne nomenklature
Vendar obstajajo tudi drugi načini, kako poklicati ZNS poleg tega, ki je že vzgojen. V sistematičnem je število atomov vsakega elementa določeno z grškimi števci, z edino izjemo elementa na desni strani, ko je samo eden. Tako je ZNS imenovan kot: Žemljacinkov sulfid (in ne monozinc monosulfuro).
Glede tradicionalne nomenklature, cinku, ko ima eno samo valenco +2, dodamo z dodajanjem priponke -co. Posledično je njegovo tradicionalno ime: zínc sulfidICO.
Cink sulfid uporablja
Kot pigmenti ali premazi
Sachtolith
Sachtholith je beli pigment, narejen z cinkovim sulfidom. Uporablja se v pulti, mastike, tesnilnih masatih, spodnjih prevlekah, barvah iz lateksa in oznak.
Njegova uporaba v kombinaciji z vpojnimi pigmenti ultravijolične svetlobe, kot so mikro titan ali prozorni pigmenti železovega oksida, je potrebna pri vremenu -rezistentnih pigmentih.
Slike ZN in lateks
Ko se ZNS uporablja v lateksu ali teksturirani sliki, ima podaljšano mikrobicido.
Okvirji in okviri letala
Zaradi svoje velike trdote in odpornosti proti lomljenju, eroziji, dežju ali prahu je primeren za zunanja infrardeča okna ali v okvirih zrakoplovov.
Prevleka in druge uporabe
ZNS se uporablja pri prevleki rotorjev, ki se uporabljajo pri transportu spojin, za zmanjšanje obrabe. Poleg tega se uporablja pri proizvodnji tiskanih črnil, izolacijskih spojin, termoplastične pigmentacije, plastiki, odporni na elektroluminiscentne plamene in svetilke.
Vam lahko služi: Tunsen Laye: Značilnosti, funkcije, primeri uporabeNaprave in zasloni nočnega vida
-Cinkov sulfid je lahko prozoren, saj ga je mogoče uporabiti kot okno za vidno optiko in infrardečo optiko. Uporablja se v napravah nočnega vida, na televizijskih zaslonih, radarskih zaslonih in fluorescentnih premazih.
Elektroluminiscenca
ZNS doping s CU se uporablja pri proizvodnji elektroluminiscenčnih plošč. Poleg tega se uporablja v raketnem pogonu in gravimetriji.
Za njegovo fosforescenco
Njegova fosforescenca se uporablja za barvanje igle in tako vizualizira čas v temi; Tudi v slikah za igrače, signali za nujne primere in obvestila o prometu.
Fosforescenca omogoča uporabo cinkovega sulfida v katodnih ceveh in na rentgenskih zaslonih, da sije v temnih točkah. Barva fosforescence je odvisna od uporabljenega aktivatorja.
Polprevodnik, fotokatiranje in katalizator
- Spheny in Wurtzit sta širokopasovni razcepljeni polprevodniki. Sphalerite ima 3,54 EV pasu, medtem ko ima Wurtzita bit 3,91 EV -Band.
- ZNS se uporablja pri pripravi fotokatalizatorja, sestavljenega iz CD -.
- Posega kot katalizator za razgradnjo organskih onesnaževal. Uporablja se pri pripravi barvnega sinhronizatorja v LED svetilkah.
- Njegovi nanokristali se uporabljajo za ultrasenzibilno odkrivanje beljakovin. Na primer z izdajo kvantnih točk Zns. Uporablja se pri pripravi kombiniranega fotokatalizatorja (CDS/ZnS) -TIO2 za električno proizvodnjo s pomočjo fotoelektrokatalize.
Reference
- Pubchem (2018). Cinkov sulfid. Vzeto od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Quiminet (16. januar 2015). Beli pigment, ki temelji na cinkovem sulfidu. Okreval od: Quiminet.com
- Wikipedia (2018). Cinkov sulfid. Vzeto od: v.Wikipedija.org
- II-VI UK (2015). Cinkov sulfid (ZN). Vzet iz: ii-vi.je
- Rob Toreki (30. marec 2015). Struktura cincblende (ZNS). Vzet od: ilpi.com
- Kemija librettexts (22. januar 2017). Blend structure-Zinc (ZNS). Vzet od: kem.Librettexts.org
- Read (2018). Sulfidni sulfid/ cink (ZN). Vzeto od: Reade.com

