Struktura natrijevega sulfata (NA2SO4), lastnosti, uporabe, pridobivanje

- 3473
- 680
- Don Nitzsche
On natrijev sulfat Je anorganska sol, katere kemična formula je na2SW4. Sestavljen je iz bele trdne snovi, ki je prisotna v treh oblikah: brezvodni, heptohidrat (malo obstoja) in razpadanja (ki je znana kot Glaubert Salt); Slednje je najpogostejša oblika natrijevega sulfata.
Natrijev sulfat razcveta, Na2SW4· 10H2Ali pa ga je leta 1625 odkril Glaubert v vodi pomladi, ki jo je imenovala Saltabilis (čudežna sol) zaradi svojih zdravilnih lastnosti.
 Urano steklo z vzorcem natrijevega sulfata. Vir: Walkerma prek Wikipedije.
Urano steklo z vzorcem natrijevega sulfata. Vir: Walkerma prek Wikipedije. Natrijev sulfat ima številne aplikacije v tekstilni in papirni industriji, pa tudi v proizvodnji stekla. Njegove uporabe so razširjene s toplotnimi aplikacijami, ki vključujejo oskrbo s toploto v okolju in hlajenje prenosnikov.
Natrijev sulfat je spojina nizke strupenosti in njegovih škodljivih dejanj, v bistvu so mehanski in nekemični. Za2SW4, predstavlja okvir in polimorfne strukture.
[TOC]
Struktura
Brezvodna sol
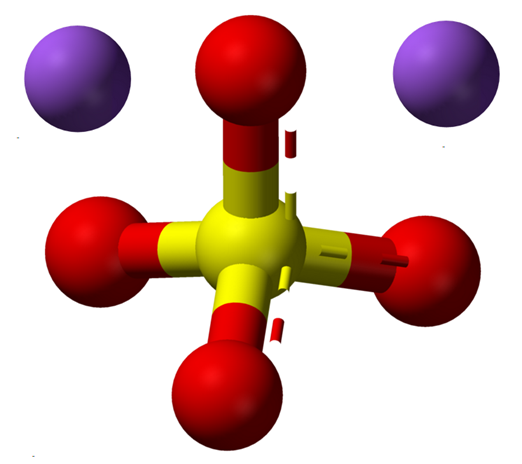 Brezvodni ioni natrijevega sulfata. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Brezvodni ioni natrijevega sulfata. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Formula NA2SW4 Označuje enkrat ioni v kristalih soli+ In tako42- So v razmerju 1: 2; to je za vsaka dva kationa na+ Obstaja anion42- interakcijo z njimi z elektrostatično privlačnostjo (vrhunska slika).
Seveda to velja za NA2SW4 brezvodna, brez molekul vode, usklajenih z natrijem v kristalih.
 Natrijev sulfat
Natrijev sulfat Kljub preprostemu videzu je njegov opis strukturno zapleten. Na2SW4 Predstavlja polimorfizem, ki ima do pet kristalnih faz: I, II, III, IV in V, katerih prehodne temperature so 180, 200, 228, 235 in 883 ° C.
Čeprav ni nobenih referenc, ki bi to potrdila, NA2SW4I mora biti tista, ki ima šesterokotno kristalno strukturo, bolj gosto v primerjavi z NA OrTorrombic2SW4Iii, v čigar kristali Na+ Oblika tetraedre (Nao4) in oktahedros (Nao6) usklajevanje; to pomeni, da ga lahko obdajajo štiri ali šest anionov42-.
Sol Decayedratada
Medtem je monoklinska kristalna struktura njegovega najpomembnejšega hidrata, NA2SW4· 10H2Ali pa je preprosteje. V njem so praktično molekule vode, ki delujejo ali se usklajujejo z NA+ V oktaedri na (h2Da)6+, S SO42- komaj prispeva zadostno stabilnost v kozarec, da obstaja v trdni fazi.
Lahko vam služi: prva revolucija kemijeVendar pa njegova tališče (32,38 ° C) precej nižja kot pri brezvodni soli (884 ° C) kaže, kako molekule vode in njihovi vodikovi mostovi oslabijo ionske interakcije, močneje v NA2SW4.
Lastnosti
Imena
-Natrijev sulfat (IUPAC)
-Glauber Sol (dehidrat)
-Sala čudežna (razcvet)
-Disodijev sulfat.
Molarna masa
142,04 g/mol (anh¡dro)
322,20 g/mol (decidrat)
Fizični videz
Bela higroskopska kristalna trdna trdna
Vonj
Stranišče
Okus
Grenka in slana
Gostota
2.664 g/cm3 (brezvodna)
1.464 g/cm3 (Dahidrat)
Upoštevajte, kako molekule vode znotraj kristalov povzročajo razširitev in zato zmanjšujejo njihovo gostoto.
Tališče
884 ° C (brezvodna)
32,38 ° C (decidrat)
Vrelišče
1.429 ° C (brezvodna)
Topnost vode
4,76 g/100 ml (0 ° C)
13,9 g/100 ml (20 ° C)
42,7 g/100 ml (100 ° C)
Vse vrednosti topnosti ustrezajo brezvodni soli, ki je v vodi precej topna pri vseh temperaturah.
Topnost se naglo poveča med 0 ° C in 38,34 ° C, pri čemer opaža, da se v tem območju temperatur topnost poveča več kot 10 -krat. Vendar je od 32,38 ° C topnosti neodvisna od temperature.
Zgodi se, da se pri temperaturi 32,8 ° C natrijev sulfat raztopi v svoji kristalni vodi. Zato je ravnovesje med razpadalno soljo, anhidrasto sol in nasičeno raztopino natrijevega sulfata.
Dokler se ohrani trifazni pogoj, bo temperatura ostala konstantna, kar omogoča, da se temperatura termometrov kalibrira.
Po drugi strani pa so topnosti za heptahidratno sol:
19,5 g/100 ml (0 ° C)
44,0 g/100 ml (20 ° C)
Upoštevajte, da je pri 20 ° C heptahidratna sol trikrat bolj topna kot brezvodna.
Lomni količnik
1.468 (brezvodni)
1.394 (decidrat)
Stabilnost
Stabilen pod priporočenimi pogoji za shranjevanje. Nezdružljivo z močnimi kislinami in bazami, aluminijem in magnezijem.
Razgradnja
Ko se segreje na razgradnjo, oddaja strupeni dim žveplovega oksida in natrijevega oksida.
ph
5 % vodna raztopina ima pH 7.
Reaktivnost
Natrijev sulfat se v vodni raztopini loti v 2 na+ In tako42-, kar omogoča, da se sulfatni ion združi z BA2+ Za oborino barijev sulfat. Praktično pomaga premikati barijeve ione vzorcev vode.
Vam lahko služi: transaminacijaNatrijev sulfat postane natrijev sulfid z reakcijo pri visokih temperaturah s premog:
Na2SW4 + 2 C => na2S +2 co2
Glaubertova sol, Naso4.10H2O reagira s kalijevim karbonatom, da nastane natrijev karbonat.
Prijave
Papirna industrija
Natrijev sulfat se uporablja v proizvodnji papirja. Uporablja se pri izdelavi papirja Kraft, ki ne vsebuje lignina ali podreja postopku beljenja, razlog, ki mu daje velik odpor. Poleg tega se uporablja pri proizvodnji kartona.
Detergenti
Uporablja se kot sintetični material za polnjenje detergenta za uporabo doma in doda detergentu za zmanjšanje površinske napetosti.
Kozarec
Uporablja se v proizvodnji stekla za zmanjšanje ali odpravo prisotnosti majhnih zračnih mehurčkov v staljenem steklu. Poleg tega odpravlja tvorbo žlindre med postopkom rafiniranja staljenega stekla.
Tekstilna industrija
Natrijev sulfat se uporablja kot mordant, saj olajša interakcijo barvil s tkaninami. Detahidrirani natrijev sulfat se uporablja pri preskusu barvila.
Poleg tega se natrijev sulfat uporablja kot barvilo razredči in pomožno tiskarsko sredstvo; kot so neposredna barvila, žveplovi barvi in drugi povzročitelji, ki dajejo prednost obarvanju bombaža. Uporablja se tudi kot agent, ki zamuja neposredna barvila svile.
Zdravilo
Decahrid natrijev sulfat se uporablja kot odvajalo, saj se v črevesju malo absorbira, zato ostane v luči tega, kar povzroči povečanje volumna. To spodbuja povečanje peristaltičnih kontrakcij, kar povzroča izgon črevesne vsebnosti.
Natrijev sulfat je protistrup za nadzor zastrupitve z barijem in svinčenimi soli. Glaubert sol je učinkovita za odpravo nekaterih zdravil, ki jih pretirano zaužijejo; Na primer paracetamol (acetoaminofen).
Poleg tega se uporablja za oskrbo slabih elektrolitov s prisotnostjo v izoosmotskih raztopinah.
Sušilno sredstvo
Natrijev sulfat, ker je inertni reagent, se uporablja za odstranjevanje vode iz organskih spojinskih raztopin.
Surovina
Natrijev sulfat se uporablja kot surovina za proizvodnjo številnih snovi, vključno z: natrijevim sulfidom, natrijevim karbonatom in amonijevim sulfatom.
Vam lahko služi: plinska kromatografijaPridobivanje
Natrijev sulfat dobimo z rudarsko ekstrakcijo in kemičnimi reakcijami.
Rudarsko ekstrakcija
Obstajajo tri rude ali minerale, ki se izkoriščajo s komercialno uspešnostjo: TANDARDITA (NA2SW4), Mirabilita (NA2SW4· 10H2O) in glaubarita (NA2SW4·Ovitek4).
V Španiji se nahajališča Thanardita in Mirabilita izkoriščajo z podzemnim rudarjenjem galerij in stebrov. Medtem je Glauberita na prostem pridobljena z velikimi splavi, ki so nameščeni na mineralnem rezervoarju.
Teren je pripravljen z nizko intenzivnostjo, da nastane poroznost, ki omogoča izpiranje natrijevega sulfata. Faza proizvodnje se pojavlja s škropljenim namakanjem s sladko vodo iz Glauberita, katere izpiranje se širi na padajoči način.
Zbira se natrijeva sulfatna slanica, ostanki kalcijevega sulfata.
Kemična proizvodnja
Natrijev sulfat dobimo med proizvodnjo klorovodikove kisline skozi dva procesa: proces Mannheima in proces hardgrenave.
Mannheim postopek
Naredi se v velikih jeklenih pečicah in s 6 m jekleno reakcijsko ploščadjo. Reakcija se pojavi med natrijevim kloridom in žveplovo kislino:
2 NaCl +H2SW4 => 2 HCl +na2SW4
Trdost postopek
Vključuje reakcijo natrijevega klorida, žveplovega oksida, kisika in vode:
4 NaCl + 2 Torej2 + Tudi2 + 2 h2O => 4 hcl +na2SW4
Drugi
Natrijev sulfat se pojavi v reakciji nevtralizacije med natrijevim hidroksidom in žveplovo kislino:
2 NaOH +H2SW4 => Na2SW4 + H2Tudi
Natrijev sulfat je stranski produkt proizvodnje številnih spojin. Izvleče se iz tekočih odpadkov, izpuščenih med proizvodnjo viskoze in celofana. Tudi pri proizvodnji natrijevega dikromata, fenolov, borove kisline in litijevega karbamata.
Tveganja
Natrijev sulfat velja za spojino z nizko toksičnostjo. Vendar lahko povzroči nekaj škode osebi, ki jo uporablja neprimerno.
Na primer, lahko povzročite draženje oči, rdečico in bolečino. V koži lahko pri nekaterih ljudeh povzroči draženje in alergijo. Njegovo zaužitje lahko povzroči draženje prebavnega trakta s slabostjo, bruhanjem in drisko. In končno njegovo vdihavanje povzroči draženje v dihalnem traktu.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Natrijev sulfat. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Natrijev sulfat. Baza podatkov Pubchem. Cid = 24436. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- B. N. Mehrotra. (1978). Kristalna struktura Na2SW4Iii. Okreval od: rruff-2.geo.Arizona.Edu
- Glauberita-thenardita (natrijev sulfat). [PDF]. Okreval od: Igme.je
- « Struktura cinkovega oksida (ZnO), lastnosti, uporabe, tveganja
- Laktofenol modre značilnosti, sestava, priprava, uporabe »

