Struktura bakrovega sulfata pentahidrata, lastnosti, uporablja

- 781
- 39
- Mr. Shane Larkin
On Pentahidrat bakreni sulfat Gre2Da). Vsebuje bakrene ione (ii) (Cu2+) in sulfat (tako42-). Njegova kemična formula je cuso4 •5H2Tudi.
V naravi tvori mineral halcantite ali kalanta, imenovan tudi Chalclasa ali Calclasa. Je modra kristalna trdna.
 Bakreni sulfat cuso bakreni sulfat4 •5H2Tudi. Avtor: überraschungsbilder. Vir: Wikimedia Commons.
Bakreni sulfat cuso bakreni sulfat4 •5H2Tudi. Avtor: überraschungsbilder. Vir: Wikimedia Commons. Uporablja se kot prehransko dopolnilo nekaterim živalim, kot so prežvekoval, prašiči in perutnina. V kmetijstvu je kot pesticid. V rudarskih dejavnostih omogoča obnovo drugih kovin.
Za svoj modri odtenek služi za obarvanje tkanin in kovin. Uporablja se za odlaganje kovinskega bakra na celulozna vlakna za pridobivanje električnih prevodnih tkanin. Uporablja se tudi za pripravo bakrenih nanodelcev in njegovih oksidov z različnimi aplikacijami.
V visokih koncentracijah je lahko strupen za favno in floro, zato se včasih uporablja za odpravljanje škodljivcev (živali ali rastlin) vodnih okolij, kot so lagune in naravni ribniki.
[TOC]
Struktura
To spojino tvori bakreni element v njegovem oksidacijskem stanju +2 in sulfatni anion. Slednji ima atom žvepla z Valencijo +6, obkroženo s štirimi kisikovimi atomi, vsak z Valencijo -2. Na ta način ima sulfatni ion dve negativni naboji.
V svoji strukturi ima tudi 5 molekul vode. Na naslednji sliki lahko vidite način, kako so razporejeni različni atomi v kozarcu.
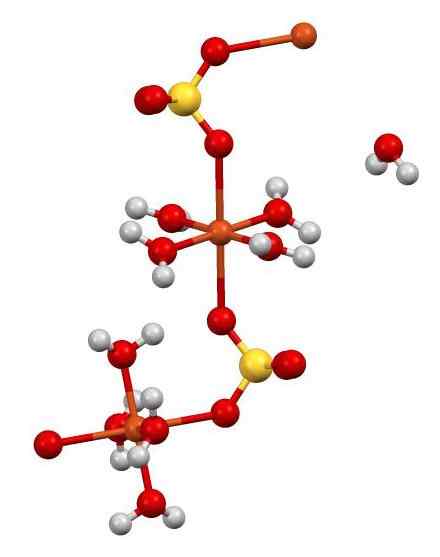 Cuo struktura4 •5H2Tudi. Avtor: Smokefoot. Vir: Wikimedia Commons.
Cuo struktura4 •5H2Tudi. Avtor: Smokefoot. Vir: Wikimedia Commons. Cu2+ (oranžne krogle) se hkrati usklajuje s 4 h molekulami2O (kisik = rdeča; vodik = bela) in z 2 kisikovimi atomi SOS42- (žveplo = rumena). Na sliki ena od H molekul2O je v očitni svobodi, vendar je del kristalne strukture.
Nomenklatura
 Mineral iz Chalkantita Cuso4 •5H2Tudi. Avtor: Archaeodontosaurus. Vir: Wikimedia Commons.
Mineral iz Chalkantita Cuso4 •5H2Tudi. Avtor: Archaeodontosaurus. Vir: Wikimedia Commons. - Pentahidrat bakreni sulfat
- Baker trpljenje (ii) pentahidrat
- Bluejack
- Modri kamen (angleščina Modri kamen)
- Chalkantita, Callantita, Chalclasa ali Callasa
Lastnosti
Fizično stanje
Modra kristalna trdna.
Molekularna teža
249.686 g/mol
Tališče
Ko doseže 110 ° C, se pokvari.
Gostota
2.286 g/cm3
Topnost
Voda topna: 22,0 g/100 g vode pri 25 ° C. Metanol topen (izberite3OH). Rahlo topen v etanolu (izberite3Pogl2OH).
Kemične lastnosti
Ta spojina, ko pridete v stik z vodo, se raztopi in tvori ione cu2+ In tako42-. Njegova topnost v vodi se znatno zmanjša, če je žveplova kislina prisotna v vodi.
Lahko vam služi: kamforozni alkohol: struktura, formula, lastnosti in uporabeH2SW4 Zagotavlja ione42- In njegova prisotnost ustvarja učinek "skupnega iona", saj je ta ion prisoten v pentahidratnem bakrenem sulfatu. Razpustitev se lahko izrazi na naslednji način:
Cuso4 •5H2Ali (trdna) + voda ⇔ cu2+ + SW42- + voda
Torej, če je SO že prisoten v rešitvi42- žveplove kisline se ravnovesje premakne v levo, torej proti tvorbi trdne snovi in s tem se topnost zmanjša.
Pridobivanje
Eden od načinov za pridobitev pentahidratnega bakrenega sulfata je raztapljanje minerala malahita v vodni raztopini žveplove kisline (H2SW4) pri nadzorovani temperaturi. Malquita vsebuje Cu2(OH)2Co3 Z drugimi nečistočami, kot je železo.
Nečista raztopina bakra (II) se zdravi z vodikovim peroksidom (H2Tudi2) zagotoviti nečistoče železa (ii) (vera2+) postati železo (iii) (vera3+). Slednje je narejeno v obliki železovega hidroksida (vera (OH)3) Uporaba natrijevega hidroksida (NaOH).
Oborina pomeni, da se v raztopini tvorijo delci netopne trdne snovi, ki pade na dno posode, ki ga vsebuje.
 Videz koncentrirane raztopine CUSO4 •5H2Tudi. Avtor: javne domene. Vir: Pixabay.
Videz koncentrirane raztopine CUSO4 •5H2Tudi. Avtor: javne domene. Vir: Pixabay. Nastala zmes se filtrira, da odstranimo trdno snov (OH)3 Preostalo tekočino pa se zdravi z etanolom (c2H5Oh), metanol (izberite3Oh) ali žveplova kislina, da obori vse ione Cu2+ cuo4 •5H2Tudi.
Pri dodajanju na primer etanol je za Cu ione na voljo manj vode2+ In tako42- so v rešitvi in se ponavadi združijo. Deluje kot dehidriranje. Bolj etanol je dodan bolj trden.
Oborino trdno snov lahko rekristizira, da jo očistite. Če želite to narediti, se raztopi v vodi pri temperaturi 80-90 ° C, nato pa se raztopina ohladi pri 25-30 ° C. Pentahidratna spojina spet hiti in nečistoče ostanejo v rešitvi.
Prijave
Ima širok interval komercialnih aplikacij.
Na področju kmetijstva služi kot pesticid, insekticid, herbicid, fungicid, malice in aditiv. V veterinarskih terapijah se uporablja kot antihelmintik, fungicid in emético (da povzroča bruhanje).
Uporablja se kot modri ali zeleni pigment v barvilih in barvilih, kot mordant v barvi tkanin in kovin. Tudi kot vtični toner na fotografijah in kot reagent za okrepitev negativnosti.
Vam lahko služi: učinkovita jedrska obremenitevUporablja se v rudarskih dejavnostih kot flotacijski reagent za obnovitev cinka in svinca. Služi za proizvodnjo drugih bakrenih spojin, uporablja se v porjavelu.
V hrani za živali
Ta spojina se uporablja pri prehrani prašičev v zelo majhnih količinah kot promotor rasti, zlasti v zadnji fazi. Mehanizem, s katerim ima ta učinek, še vedno ni znan.
Nekateri raziskovalci trdijo, da zmanjšuje populacijo patogenih ali škodljivih bakterij v črevesju živali in posledično daje prednost njihovi rasti.
 S CUSO4 •5H2O lahko dajete prednost razvoju odstavljenih prašičev. Avtor: Mabelamber. Vir: Pixabay.
S CUSO4 •5H2O lahko dajete prednost razvoju odstavljenih prašičev. Avtor: Mabelamber. Vir: Pixabay. Drugi učenjaki kažejo, da izboljšuje zdravje črevesja teh živali, vendar nekatere preiskave kažejo, da intravenska injiciranje bakra prav tako izboljša njegovo rast.
Uporablja se tudi za isti namen pri perutnini in se uporablja pri pomanjkanju bakra prežvekovalcev.
V sintezi nanodelcev
Za pridobivanje mešanih bakrenih nanodelcev in bakrenega oksida (I) (Cu/Cu je bil uporabljen pentahidrat bakreni sulfat2Da).
Nanodelci so izjemno majhne strukture, ki jih je mogoče videti le z elektronskim mikroskopom.
Cu/cu prah2O V obliki nanodelcev, ki jih uporablja pri katalizi ali pospeševanju kemičnih reakcij, v polprevodnikih in v protimikrobnih materialih, med drugimi aplikacijami.
V študijah za zatiranje škodljivcev
Cuso4 •5H2Ali pa se uporablja v izkušnjah za oceno svoje strupenosti do polžev vrste Pomacea Canaliculata.
To so domači mehkužci tropskih regij Južne Amerike, ki naseljujejo različne vrste ekosistemov, od močvirja in lagune do jezer in rek.
Preučujemo jih, ker nekateri gostijo človeške parazite, kot je Schistosoma mansoni (Trematoda, ki proizvaja bolezen Bilharzije). Karacole so lahko škodljive tudi za kmetijske pridelke poplavljenih regij.
 Caparazones de los Caracoles Pomacea Canaliculata. H. ZELL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Caparazones de los Caracoles Pomacea Canaliculata. H. ZELL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.  Jajca, ki jih polži odložijo v vodni rastlini. Ti polži včasih predstavljajo kugo, ki jo je mogoče nadzorovati s Cuso4 •5H2Tudi. Shan LV, Nacionalni inštitut za parazitske bolezni/CC (https: // creativeCommons.Org/licence/by/2.5). Vir: Wikimedia Commons.
Jajca, ki jih polži odložijo v vodni rastlini. Ti polži včasih predstavljajo kugo, ki jo je mogoče nadzorovati s Cuso4 •5H2Tudi. Shan LV, Nacionalni inštitut za parazitske bolezni/CC (https: // creativeCommons.Org/licence/by/2.5). Vir: Wikimedia Commons. Glede na pregledane študije so vodne raztopine bakrovega sulfata izredno strupene za te polže, zato lahko to spojino uporabimo za odpravo mehkužca iz okuženih območij.
Vam lahko služi: reakcije izgorevanjaV skladu z določenimi preiskavami je to zato, ker polž nima potrebe po bakrenem ionu, zato bi samo stik s tem ionom zadostoval, da se žival zgodi.
V električnih prevodnih tkaninah
Ta spojina je bila uporabljena pri pridobivanju tekstilnih materialov z integriranimi senzorji električne energije. Ta vrsta tkanine ima uporabo na napravah za shranjevanje električne energije, tlačnih senzorjih, fotodetektorju in zaslonih za oddajanje svetlobe.
Za pridobitev električne prevodne tkanine je kovinska vlakna tkane celulozne celuloze, imenovana "liocell". Prevleka se izvaja na ne -električni način, ki temelji na raztopini CuSO4 • 5H2O in drugih pomožnih kemičnih spojin.
 Lyocelična vlakna. Ta vrsta tkanine je bila uporabljena pri preskusih bakrene prevleke. DOBROZHINETSKY/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Lyocelična vlakna. Ta vrsta tkanine je bila uporabljena pri preskusih bakrene prevleke. DOBROZHINETSKY/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Tkanina, pridobljena na ta način, lahko prenese električni signal tudi v pogojih deformacije ali raztezanja, ki vzdržuje visoko prevodnost.
Učinki na okolje
Kot je razloženo nad Cuso4 •5H2Ali pri raztapljanju v vodi ustvari bakreni ion (ii).
Čeprav je baker bistvenega.
Zato prisotnost tega iona v okolju predstavlja tveganje za živali in rastline. V vodnih ekosistemih je lahko bioakumulirano pri živih bitjih in v prehranski verigi, kar povzroči škodo.
 Cuso4 •5H2O lahko škoduje vodnim okoljem. Avtor: Jamesdemers. Vir: Pixabay.
Cuso4 •5H2O lahko škoduje vodnim okoljem. Avtor: Jamesdemers. Vir: Pixabay. Pravzaprav je bilo v nekaterih izkušnjah ugotovljeno, da kontaminacija vodnih okolij s pentahidratom bakrenim sulfatom povzroči, da se biomasa nekaterih vodnih rastlin zmanjša.
Kar pomeni, da rastline v prisotnosti te soli v visokih koncentracijah rastejo manj.
Reference
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Koke, h. et al. (2014). Raztapljanje bakra in železa iz malahitne rude ter natančnost pentahidrata bakrovega sulfata s kemičnim procesom. Inženirska znanost in tehnologija, mednarodni časopis. 2014; 17 (1): 39–44. Okrevano od Scientirect.com.
- Azevedo B Alves., J.Str. in peixoto, m.N. (2015). Zmanjšanje biomase Moteča salvinija Izpostavljen bakrenemu sulfatnemu pentahidratu (CUO4.5H2Da). Rev. Ambient. Voda 2015; 10 (3): 520–529. Okreval od Doaja.org.
- Koren, w. et al. (2019). Fleksibilen senzor tekstilnega seva, ki temelji na tkanini celuloze, prevlečene z bakreno prevleko. Polimerji 2019, 11, 784. MDPI se je okreval.com.
- Pitlli, r.Do. et al. (2008). Akutna strupenost bakrenega sulfata in vodnega ekstrakta posušenih listov neema na polžeh (Pomacea Canaliculata). SCI ACT. Biol. Sci. 2008; 30 (2): 179-184. Okreval od Doaja.org.
- Badawy, s.M. et al. (2015). Sinteza, karakterizacija in katalitična aktivnost nanodelcev Cu/Cu2O, pripravljenih v vodnem mediju. Bilten kemijskega reakcijskega inženiringa in katalize. 2015; 10 (2): 169-174. Okreval od Doaja.org.
- Justil, f.J. et al (2014). Topnost in fizikalne lastnosti nasičenih raztopin v sistemu bakrovega sulfata + žveplove kisline + morske vode pri različnih temperaturah. Brazilski časopis za kemijsko inženirstvo. 2015; 32 (3): 629-635. Okreval od Doaja.org.
- Park, c.S. in Kim, b.G. (2016). In vitro Topnost bakra (II) sulfata in dicopper klorid trihidroksid za prašiče. Azijski Austalas. J. Odmik. Sci. 2016; 29 (11): 1608-1615. Okreval od Doaja.org.
- Ali.S. Nacionalna knjižnica medicine. (2019). Bakreni sulfat pentahidrat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Wikipedia (2020). Chalkanthit. Pridobljeno iz.Wikipedija.org.
- « Značilnosti morskih biom, vrste, flora, favna
- Voski (biološka) struktura, lastnosti, funkcije, vrste »

