Struktura bakrenega sulfata (CUSO4), lastnosti, pridobivanje, uporabe
- 4013
- 1286
- Barry Ernser
On bakreni sulfat To je anorganska spojina, ki jo tvorijo elementi bakra (Cu), žvepla (S) in kisika (O) (O). Njegova kemična formula je cuso4. Baker je v stanju oksidacije +2, žveplo +6, kisik pa ima Valencia -2.
Bela trdna snov je, da ko je izpostavljena vlagi okolja, postane njegov kusko modri pentahidrat4 •5H2Tudi. Bela trdna snov dobimo s segrevanjem modre barve, da odpravimo vodo.
 Bakreni sulfat (cuo4) brezvodna (brez vode v svoji kristalni strukturi). W. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Bakreni sulfat (cuo4) brezvodna (brez vode v svoji kristalni strukturi). W. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Že stoletja se uporablja kot antibakterijsko sredstvo za celjenje ran pri ljudeh in živalih. Deluje tudi kot fungicid, kot adstrigentni, antidiarirhealni in nadzorovani črevesni bolezni pri živalih. Uporablja se tudi kot antihongos sredstvo v rastlinah.
Vendar so nekatere njihove uporabe ukinili, ker je njihov presežek lahko strupen tako za ljudi, živali kot rastline. Interval koncentracije, v katerem ga je mogoče uporabiti, je ozek in je odvisen od vrste.
Uporablja se kot katalizator v kemičnih reakcijah in kot sušilna topila. Omogoča izboljšanje odpornosti in prožnosti nekaterih polimerov.
Prekomerne količine te spojine so lahko škodljive za tla, saj so strupene za mikroorganizme, ki so koristne za rastline.
[TOC]
Struktura
Bakreni sulfat tvori bakreni ion (Cu2+) in sulfatni ion (tako42-).
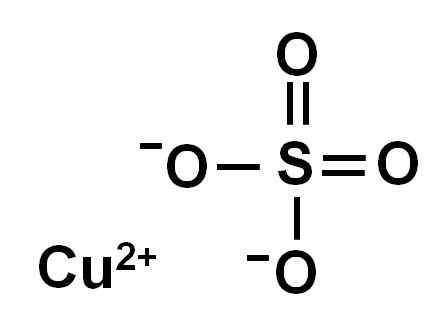 Ionica bakreni sulfat (ii). Avtor: Marilú Stea.
Ionica bakreni sulfat (ii). Avtor: Marilú Stea. Zaradi izgube dveh elektronov ima bakreni ion (II) naslednjo elektronsko konformacijo:
1s2 2s2 2 p6 3s2 3P6 3D9
Vidimo, da ima orbital 3D Nepopolno (ima 9 elektronov namesto 10).
Nomenklatura
- Brezvodni bakreni sulfat
- Bakreni sulfat (ii)
- CuPric sulfat
Lastnosti
Fizično stanje
Zelenkasto belo trdno ali kristalno.
Molekularna teža
159,61 g/mol
Tališče
Pri 560 ° C se pokvari.
Gostota
3,60 g/cm3
Topnost
22 g/100 g vode pri 25 ° C. Netopna v etanolu.
Kemične lastnosti
Ko je podvržen vlagi zraka pod 30 ° C4 •5H2Tudi.
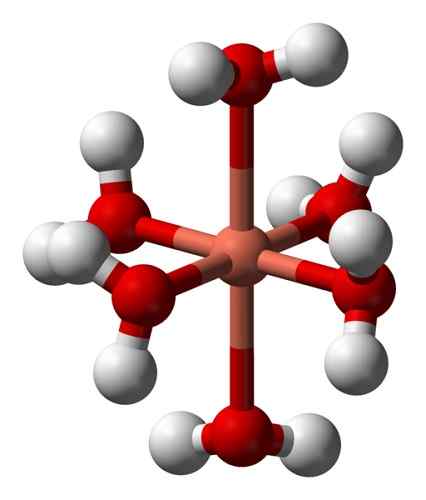
Njegove vodne raztopine so modre zaradi tvorbe heksaakuokobre iona (ii) [cu (h2Da)6]2+ ki proizvaja takšno obarvanje. V tem ionu sta dve molekuli vode dlje od kovinskega atoma kot ostali štirje.
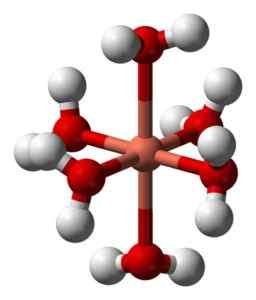 Deformirana struktura heksaacuocobre iona (ii) [cu (h2Da)6]2+. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons.
Deformirana struktura heksaacuocobre iona (ii) [cu (h2Da)6]2+. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons. To je posledica tako imenovanega Jahn-Tellerjevega učinka, ki napoveduje, da ta vrsta sistemov doživlja popačenje, ki ga povzroča dejstvo, da Cu2+ Ima elektronsko strukturo, ki se konča v D9, to pomeni, da je nepopolna orbitala (bila bi popolna, če bi bila D10).
Vam lahko služi: kalcijev hidroksid (Ca (OH) 2): struktura, lastnosti, pridobivanje, uporabeČe dodamo amoniak (NH3) Te rešitve so oblikovane, v katerih NH3 Molekule vode so zaporedno premikajoče. Nastajajo na primer iz [CU (NH3) (H2Da)5]2+ Do [CU (NH3)4(H2Da)2]2+.
Ko je Cuso4 Segreje se na njegovo razgradnjo oddaja strupene pline in postane kupracski oksid.
Pridobivanje
Brezvodni bakreni sulfat lahko dobimo s skupno dehidracijo pentahidratne spojine, kar dosežemo s segrevanjem, dokler molekule vode ne izhlapijo.
Cuso4 •5H2O + toplota → cuo4 + 5 h2Ali ↑
Spojina pentahidrata je modra, zato se voda CUSO pridobi pri izgubi vode kristalizacije4 Bela brezvodna.
Prijave
Nekatere njegove uporabe se prekrivajo s spojino pentahidrata. Drugi so značilni za brezvodno snov.
Kot antibakterijsko sredstvo
Ima potencial kot protimikrobno sredstvo. Uporablja se že tisočletja, tudi v kulturah Južne Amerike in Srednje Amerike.
Ocenjujejo, da v mehanizmu njene antibakterijske aktivnosti ioni Cu2+ Tvorijo kelate z encimi, ki so ključni za celične funkcije bakterij in jih deaktivirajo. Prav tako sprožijo tvorbo hidroksilnih radikalov OH •, ki poškodujejo membrane bakterij in njihov DNK.
 Cuso4 Lahko deluje proti nekaterim patogenim bakterijam. Avtor: Gerd Altmann. Vir: Pixabay.
Cuso4 Lahko deluje proti nekaterim patogenim bakterijam. Avtor: Gerd Altmann. Vir: Pixabay. V zadnjem času so poročali, da Cuso sledi4 Lahko povečajo protimikrobno aktivnost naravnih proizvodov, bogate s polifenoli, kot so izvlečki granat in infuzije nekaterih vrst čajnih rastlin.
V veterinarskih aplikacijah
Uporablja se kot antiseptik in adstrigent za sluznice ter za zdravljenje zunanjega konjunktivitisa in otitisa. Služi za izvajanje terapevtskih ali profilaktičnih kopeli, da se izogne gnilobi goveda, ovac in drugih sesalcev.
 Vodne rešitve Cuo4 Služijo za zdravljenje lukenj za govedo. Avtorji: Ingrid und Stefan Melichar. Vir: Pixabay.
Vodne rešitve Cuo4 Služijo za zdravljenje lukenj za govedo. Avtorji: Ingrid und Stefan Melichar. Vir: Pixabay. Služi kot kavstično sredstvo za nekrotične mase v okončinah goveda, razjed stomatitisa in granuliranega tkiva teh. Uporablja se kot fungicid pri zdravljenju barvila in bolezni, ki jih povzročajo kožne glive.
Uporablja se tudi kot emético (agent za izvozo bruhanja) pri prašičih, psih in mačkah; kot antidiarrheal adstrigent za teleta in za nadzor črevesne moniliaze v perutnini in turški trihomoniazi.
Kot dodatek za krmo za živali
Bakreni sulfat je bil uporabljen kot dodatek v zelo majhnih količinah za hranjenje goveda, prašičev in perutnine. Služi za zdravljenje pomanjkanja bakra v prežvekovalcih. V primeru prašičev in ptic se uporablja kot rastni stimulansi.
Vam lahko služi: kromatogramBaker je bil opredeljen kot bistvenega.
Kot je bilo omenjeno v prejšnjem razdelku, ga je mogoče dobaviti tudi kot zdravila za nadzor bolezni. Vendar pa je treba oskrbovati z dodatkom in/ali zdravili.
 Koralne ptice in njihova jajca lahko v njihovi prehrani vpliva presežek bakrenega sulfata. Avtor: Pexels. Vir: Pixabay.
Koralne ptice in njihova jajca lahko v njihovi prehrani vpliva presežek bakrenega sulfata. Avtor: Pexels. Vir: Pixabay. Iz določene količine, ki je odvisna od vsake vrste, lahko zmanjšanje rasti, izguba apetita in teže, poškodbe nekaterih organov in celo smrt živali lahko pride do.
Na primer, pri piščancih dopolnjevanje 0,2% ali več zmanjšuje zaužitje hrane s posledično izgubo teže, zmanjšano proizvodnjo jajc in debelino njihovega pilinga.
V kmetijskih aplikacijah
V sistemih za organsko proizvodnjo ni dovoljeno uporabljati sintetičnih fungicidov, sprejeti so le bakreni in žveplovi izdelki, na primer bakreni sulfat.
Na primer določene glive, ki napadajo jabolčne rastline, na primer Venturia inaequalis, se izločijo s to spojino. Misli se, da so morda ioni cu2+ Lahko vstopijo v glivico, denaturalizirajo beljakovine in blokirajo več encimov.
 Bakreni sulfat služi za boj proti nekaterim glivam, ki napadajo jabolka. Algirdas na Lt.Wikipedija / javna domena. Vir: Wikimedia Commons.
Bakreni sulfat služi za boj proti nekaterim glivam, ki napadajo jabolka. Algirdas na Lt.Wikipedija / javna domena. Vir: Wikimedia Commons. Pomen bakra v rastlinah
Element bakra je pomemben v fizioloških procesih rastlin, kot so fotosinteza, dihanje in obramba pred antioksidanti. Tako pomanjkljivost tega elementa kot tudi njegov presežek ustvarjata reaktivne oksigenirane vrste, ki so škodljive za molekule in strukture teh.
Interval koncentracije bakra za optimalno rast in razvoj rastlin je zelo ozek.
Neželeni učinki na kmetijstvo
Ko se ta izdelek pretirano uporablja v kmetijskih dejavnostih, je lahko fitotoksičen, povzroči prezgodnji razvoj sadja in spremeni svojo barvo.
Poleg tega se baker kopiči na tleh in je strupen za mikroorganizme in deževnike. To je v nasprotju s konceptom ekološkega kmetijstva.
 Čeprav cuso4 Uporablja se v ekološkem kmetijstvu lahko škodljivo za zemeljske črve. Avtorica: Patricia Maine DeGrave. Vir: Pixabay.
Čeprav cuso4 Uporablja se v ekološkem kmetijstvu lahko škodljivo za zemeljske črve. Avtorica: Patricia Maine DeGrave. Vir: Pixabay. O kemičnih reakcijah
Cuso4 Brezvodni služi kot katalizator za več reakcij karbonilnih organskih spojin z diolami ali njihovimi epoksidi, ki tvorijo dioksolane ali acetonide. Zahvaljujoč tej spojini lahko reakcije izvedete v mehkih pogojih.
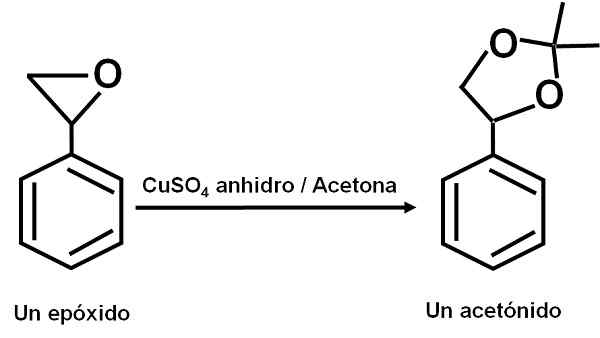 Primer reakcije, v kateri je cuso4 brezvodni deluje kot katalizator. Avtor: Marilú Stea.
Primer reakcije, v kateri je cuso4 brezvodni deluje kot katalizator. Avtor: Marilú Stea. Poročalo se je tudi, da njegovo katalitično delovanje omogoča dehidriranje sekundarnih, terciarnih, benzil in aliličnih alkoholov do ustreznih olefinov. Reakcija poteka na zelo preprost način.
Vam lahko služi: anetolČisti alkohol se segreva skupaj s cuso4 brezvodna pri temperaturi 100-160 ° C za čas 0,5-1,5 ure. Tako pride do dehidracije alkohola in olefina, čiste destilije iz reakcijske mešanice.
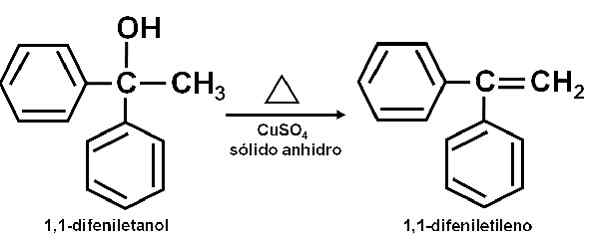 Dehidracija alkohola za bakreni sulfat (ii) brezvodna. Avtor: Marilú Stea.
Dehidracija alkohola za bakreni sulfat (ii) brezvodna. Avtor: Marilú Stea. Kot dehidralno sredstvo
Ta spojina se v kemijskih laboratorijih uporablja kot sušilna. Služi za dehidriranje organskih tekočin, kot so topila. Absorbira voda, ki tvori Cuo pentahidrat spojino4 •5H2Tudi.
 Ko je Cuso4 Bela anhidro absorbira vodo postane modra pentahidratna spojina4.5H2Tudi. Crystal Titan/CC by-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Ko je Cuso4 Bela anhidro absorbira vodo postane modra pentahidratna spojina4.5H2Tudi. Crystal Titan/CC by-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Izboljšati polimere
Cuso4 Anhidro je bil uporabljen za izboljšanje lastnosti nekaterih polimerov in hkrati omogočajo, da jih je mogoče reciklirati.
Na primer, delci acetonske spojine so v posebnem mlinu pomešani z akrilonitrilno-butadiensko gumo in poskušali narediti Cuso delce4 Biti zelo majhen.
Bakreni sulfat izboljša točke polimernega sindikata, ki tvorijo mešanico z visoko odpornostjo, trdoto in presenetljivo prožnostjo.
V prekinjenih terapevtskih aplikacijah
V preteklosti so bile uporabljene raztopine bakrenega sulfata za pranje želodca, ko je nekdo utrpel belo zastrupitev s fosforjem. Vendar se je raztopina takoj mešala, da se prepreči zastrupitev z bakrom.
Raztopine te spojine so bile uporabljene tudi z drugimi snovmi za lokalne opekline v koži s fosforjem.
Včasih so služili v določenih oblikah prehrane.
Nekateri losjoni za ekcem, impetigo in intertrigo vsebujejo CUO4. Raztopine so bile uporabljene kot adstrigent pri očesnih okužbah. Včasih smo kristale nanesli neposredno na opekline ali razjede.
Vse te aplikacije niso več narejene zaradi toksičnosti, ki lahko sprožijo odvečno spojino.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Bakreni sulfat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Montag, J. et al. (2006). In vitro študija na Venturia inaequalis. J. Agric. Food Chem. 2006, 54, 893-899. Povezava je bila obnovljena.Springer.com.
- Holloway, a.C. et al. (2011). Povečanje protimikrobnih aktivnosti celotnega in sub-frakcioniranega belega čaja z odvisnostjo iz bakrovega (II) sulfata in vitamina C proti zlati stafilokok; Do mehaničnega pristopa. BMC komplement Altern Med 11, 115 (2011). Pridobljeno iz bmcComplementMemterapies.biomedcentral.com.
- Sanz, a. et al. (2018). Mehanizem vnosa bakra Thalian Arabidopsis Prenosnik Copt z visoko stopnjo. Protoplasma 256, 161-170 (2019). Povezava je bila obnovljena.Springer.com.
- Griminger, str. (1977). Vpliv bakrenega sulfata na proizvodnjo jajc in debelino lupine. Perutninska znanost 56: 359-351, 1977. Okrevana od akademskega.Oup.com.
- Hanzlik, r.Str. In leinwetter, m. (1978). Reakcija epoksidov in karbonilnih spojin, ki jih katalizira brezvodni bakreni sulfat. J. Org. Kem., Vol.43, št.3, 1978. Okrevani iz lokalov.Acs.org.
- Okonkwo, a.C. et al. (1979). Potreba po bakra otroških prašičev, ki jih hranijo očiščeno prehrano. The Journal of Nutrition, letnik 109, številka 6, junij 1979, strani 939-948. Okrevana od akademskega.Oup.com.
- Hoffman, r.V. et al. (1979). Brezvodni baker (ii) sulfat: učinkovitost. J. Org. Kem., 1980, 45, 917–919. Okrevani iz lokalov.Acs.org.
- Shao, c. et al. (2018). Izboljšana natezna trdnost akrilonitril-butadienskih gumijastih/brezvodnih bakrenih sulfatnih kompozitov, pripravljenih s koordinacijsko navzkrižno povezavo. Polym. Bik. 76, 1435-1452 (2019). Povezava je bila obnovljena.Springer.com.
- Betts, j.W. et al. (2018). Nove antibakterijske: alternative tradicionalnim antibiotikom. baker. V napredku mikrobne fiziologije. Okrevano od Scientirect.com
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Google spletna mesta. Naredite brezvodni bakreni sulfat. V domači kemiji Paradox. Okrevano s spletnih mest.Google.com.

