Aluminijev sulfat (AL2 (SO4) 3)

- 4022
- 450
- Percy Feeney
 Kristali belega aluminijevega sulfata
Kristali belega aluminijevega sulfata Kaj je aluminijev sulfat?
On Aluminijast sulfat Je aluminijasta sol anorganske formule2(SW4)3, ki se ponavadi pojavlja kot bela trdna trdna simpatična kristala. Na barvo spojine bo vplivala njegova koncentracija železa in katera koli druga nečistoča. Obstajata dve glavni vrsti aluminijevega sulfata: A in B.
Je zelo topna solna sol, v naravi pa ga je redko najti v svoji brezvodni obliki. Običajno je hidriran v obliki oktadekahidrata aluminijevega sulfata [do2(SW4)3.18h2Ali] ali heksadekahidrat [do2(SW4)3.16h2Vse.
Prav tako lahko tvori dvojne soli s kalijem in z amonijem, spojinami, znanimi kot luči. Deloma je to lahko posledica afinitete vode znotraj hidratov, da obdrži druge ione, poleg aluminija.
Kemična struktura aluminijevega sulfata
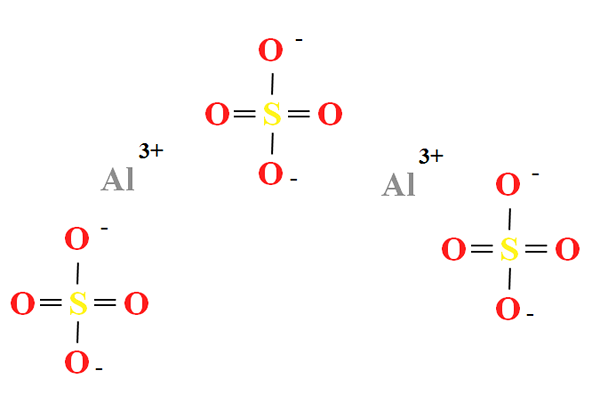 Kemična struktura aluminijevega sulfata. Vir: Gabriel Bolívar
Kemična struktura aluminijevega sulfata. Vir: Gabriel Bolívar Aluminijev sulfat ima delež dveh kationov3+ za vsake tri anione42- (Vrhunska slika), ki jo lahko opazimo neposredno v svoji kemijski formuli2(SW4)3.
Upoštevajte to3+ So sivkasti, medtem ko so SOS42- So rumene (za atom žvepla) in rdeče (po kisikovih atomih).
Ilustrirana struktura ustreza brezvodni obliki al2(SW4)3, Ker nobena molekula vode ne deluje z ioni. V svojih hidratih pa lahko vodo pritegnemo v pozitivna središča Al3+, ali za negativne tetraedre42- z vodikovimi mostovi (hah-o-so32-).
Al2(SW4)3∙ 18h2Ali na primer vsebuje 18 molekul vode v svoji trdni strukturi. Nekateri od njih so morda v neposrednem stiku z njim3+ ali s SOS42-. Z drugimi besedami: aluminijev sulfat ima lahko notranjo ali zunanjo koordinacijsko vodo.
Tudi v njeni strukturi lahko nastanejo druge katione, kot je vera3+, Na+, K+, itd. Toda za to je potrebna prisotnost več pod anioni42-, za nevtralizacijo povečanja pozitivnih obremenitev zaradi nečistoč kovin.
Aluminijev sulfat ima lahko veliko struktur, čeprav njeni hidrati ponavadi sprejemajo monoklinični kristalni sistem.
Fizikalne in kemijske lastnosti
Vidik
Predstavljen je kot trdna snov z utripajočimi belimi kristali, zrnci ali prahom.
Molekularna teža
342,31 g/mol (brezvodni).
Vonj
To je stranišče.
Okus
Sladki okus, zmerno adstrigenten.
Tališče
770 ° C ANHYDRA oblika (86,5 ° C Octadecahidrat oblika).
Topnost vode
31,2 g/100 ml pri 0 ° C; 36,4 g/100 ml pri 20 ° C in 89 g/100 ml pri 100 ° C.
Gostota
2,67 do 2,71 g/cm3.
Topnost
Rahlo topen v etilnem alkoholu.
Parni tlak
V bistvu nič.
Stabilnost
Zrak v zraku.
Razgradnja
Ko se ogreje, približno do njenega tališča, ga lahko prekinemo tako, da oddajamo zlasti žveplovi oksid, strupeni plin.
Jedkost
Raztopine aluminijevega sulfata so jedke za aluminij. Tudi spojina lahko korodira kovine v prisotnosti vlage.
Vam lahko služi: glukoneogenezaPKA
3.3 do 3.6. In njegov pH je 2,9 ali več v vodni raztopini pri 5%.
Uporaba aluminijaste sulfata
Koagulacija ali flokulacija vode
- Ko je pomešana z vodo (pitno, serviran ali odpadki), aluminijev sulfat povzroči aluminijev hidroksid, ki tvori kompleksno s spojinami in delci v raztopini s pospeševanjem njegove usedline, kar bi ob obdelavi z aluminijem sulfata trajalo pozno dolgo.
- Aluminijev sulfat se uporablja tudi pri čiščenju vode v bazenu, zaradi česar so bolj privlačni za uporabo.
- Z uporabo aluminijevega sulfata dosežemo vodo, ki ni motnosti in barve. Žal ta metoda čiščenja lahko privede do rahlo povečane koncentracije aluminija v vodi.
- Aluminij je zelo strupena kovina, ki se kopiči v koži, možganih in pljučih, kar povzroča resne motnje. Poleg tega ni znano, kaj funkcijo izpolnjuje pri živih bitjih.
- Evropska unija zahteva, da največja dovoljena meja aluminija v vodi ne presega 0,2 mg/L. Po drugi strani ameriška agencija za zaščito za okolje zahteva, da največja meja onesnaževanja vode z aluminijem ne presega 0,05-0,2 mg/l.
- Zdravljenje vode, ki se uporabljajo ali postrežejo z aluminijevim sulfatom, omogoča izločanje ali zmanjšanje fosforja v njih, ekonomsko.
Uporabljam kot Ink Mordant in v izdelavi prispevka
- Aluminijev sulfat je bil uporabljen kot mordant barvil ali črnila, ki pomaga pri iskanju tekstilnega gradiva. Njegovo pritrdilno dejanje je posledica AL (OH)3, katere želatinasta doslednost sodeluje z adsorpcijo barvil nad tekstilom.
- Čeprav se uporablja od približno 2000 do.C. Z opisanim namenom le organska barvila zahtevajo mordane. Sintetična barvila na drugi strani ne potrebujejo mordanov, da izpolnijo svojo funkcijo.
- Razseljen je iz proizvodnje papirja, vendar se še vedno uporablja pri izdelavi papirnate kaše. Odstranite svoje nečistoče, pa tudi za povezovanje materialov, nevtralizacijo obremenitev in umerjanje kolofonije.
Industrijska uporaba
- Uporablja se v gradbeni industriji za pospešitev nastavitve betona. Poleg tega se uporablja pri hidroizolaciji konstrukcij.
- V milih in debelih industriji se uporablja v proizvodnji glicerina.
- V naftni industriji za izdelavo sintetičnih katalizatorjev, ki jih uporabljajo med svojim delovanjem.
- Uporablja se v farmacevtski industriji kot adstrigent pri pripravi drog in kozmetike.
- Posega v izdelavo barvil, kot je Carmine. Uporablja se tudi kot barvilo pri proizvodnji sintetičnega gumijastega buttadiena stretusa.
- V industriji proizvodnje sladkorja se uporablja kot čistilec melase sladkornega trsa.
- Uporablja se pri izdelavi deodorantov, saj povzroča zoženje kanalijskih kanali.
- Uporablja se v usnjenem stroju, ki je potreben za uporabo. Poleg tega se uporablja pri proizvodnji gnojil.
- Uporablja se kot dodatek pri izdelavi slik, lepil in tesnilnih mas, pa tudi čistilne in skrbne izdelke pohištva.
Zdravilne in terapevtske uporabe
- Aluminijev sulfat je imunski adjuvant. Zato izpolnjuje funkcijo obdelave antigenov tako, da ko se sprostijo na svoje mesto delovanja.
- Adjuvant Freund in BCG ter drugi adjuvanti, vključno z endogeni, kot so interlevkini. To je omogočilo izdelavo cepiv proti številnim boleznim.
- Koagulantno delovanje aluminijevega sulfata je med drugim omogočilo izločanje številnih virusov v obdelani vodi, kot so beta, MS2, T4 in P1. Rezultati kažejo, da obdelava vode z aluminijevim sulfatom povzroči inaktivacijo takšnih virusov.
- Aluminijev sulfat se uporablja v baru ali kot prah pri zdravljenju majhnih površinskih ran ali odrgnin, ki jih proizvaja britje.
- Uporablja se pri proizvodnji aluminijevega acetata, spojine, ki se uporablja pri obdelavi nekaterih ušesnih pogojev. Brez pomembnega uspeha je bil uporabljen tudi za lajšanje posledic ugrizov požara.
- Aluminijeve raztopine sulfata se pri koncentraciji od 5% do 10% uporabljajo pri lokalnem zdravljenju razjed, ki omogočajo nadzor nad njihovimi izločki.
- Adstrigentno delovanje aluminijevega sulfata krči površinske plasti kože, koagulirajo beljakovine in zdravilne rane.
Druge uporabe
- Aluminijev sulfat pomaga pri nadzoru prekomerne rasti alg v ribnikih, jezerih in vodnih tokovih. Uporablja se tudi pri izločanju mehkužcev, med njimi, španski polž.
- Vrtnarji to spojino nanesejo za nakinitev alkalnih tal. V stiku z vodo se aluminijev sulfat razgradi v aluminijevem hidroksidu in razredčeno žveplovo kislino. Nato oborine aluminijevega hidroksida, preostala žveplova kislina.
- Zakisanje tal zaradi žveplove kisline je vizualizirano na zelo kreativen način zaradi obstoja rastline, imenovane Hydrangea, katere cvetovi postanejo modro v prisotnosti kisle zemlje; to pomeni, da so občutljivi in se odzivajo na spremembe pH.
- Aluminijev sulfat poseže v izdelavo pene za boj in nadzor požara: reagira z natrijevim bikarbonatom, kar povzroči sproščanje CO2. Ta plin blokira dostop O2 na mesto zgorevanja gradiva in posledično prenehanje požara, ki se je razvijal.
Proizvodnja aluminijevega sulfata
Aluminijev sulfat se sintetizira z reakcijo spojine, bogate z aluminijem, kot je mineral boksita, z žveplovo kislino pri visokih temperaturah. Naslednja kemična enačba predstavlja reakcijo:
Do2Tudi3 + H2SW4 -> Al2(SW4)3 + 3 h2Tudi
Aluminijev sulfat se lahko tvori tudi z nevtralizacijsko reakcijo med aluminijevim hidroksidom in žveplovo kislino v skladu z naslednjo reakcijo:
2 do (OH)3 + 3 h2SW4 + 12 h2Ali ->2(SW4)3.18h2Tudi
Žveplova kislina reagira z aluminijem, da tvori amonijev sulfat in sproščanje vodikovih molekul v obliki plina. Reakcija je shematizirana na naslednji način:
2 do +3 h2SW4 -> Al2(SW4)3 + 3 h2
Vrste aluminijevega sulfata
Aluminijev sulfat je razvrščen v dve vrsti: tip A in tip B. V aluminijevem sulfatu tipa A so trdne snovi bele in imajo koncentracijo železa manj kot 0,5%.
V aluminijevem sulfatu tipa B so trdne snovi rjave in imajo koncentracijo železa manj kot 1,5%.
Obstajajo panoge, ki proizvajajo aluminijev sulfat, ki imajo različna merila za razvrstitev. Tako industrija poroča za pripravo tipa aluminijevega sulfata do največje koncentracije 0,1% železa kot železovega oksida.
Medtem ko za tip B kažejo največjo koncentracijo železa 0,35%.
Toksičnost aluminija sulfata
- Aluminijev sulfat je spojina, ki izvaja njegovo strupeno delovanje s stikom s svojim prahom in tako povzroči draženje kože in v primerih, ko je stik pogost, dermatitis.
- V očeh povzroča močno draženje, celo povzroči trajne poškodbe.
- Njegovo vdihavanje povzroča draženje nosu in grla, kar lahko povzroči kašelj in carraspero.
- Njegov vnos povzroča draženje želodca, slabost in bruhanje.
- Obstajajo strupeni učinki, da čeprav niso neposredno zaradi aluminijevega sulfata, so posredno za njihovo uporabo. To je primer nekaterih strupenih učinkov aluminija, ki jih povzroči uporaba aluminijevega sulfata pri čiščenju vode.
- Bolniki, ki jih kronično diapiramo s soli, pripravljenimi v prečiščeni vodi z uporabo aluminijevega sulfata, doživljajo zelo hude zdravstvene motnje. Med temi motnjami omenjamo anemijo, dializno demenco in povečanje bolezni kosti.
Reference
- Wikipedija. (2018). Aluminijast sulfat. Vzeto od: v.Wikipedija.org
- Industrijski aris. Aluminijev sulfat tipa A in B. Vzeto iz: ARIS.com.pe
- Christopher Boyd. (9. junij 2014). Top Industrial uporabe za aluminijev sulfat. Vzet od: chemService.com
- Pubchem. (2018). Aluminijev sulfat brezvodni. Vzeto od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kemična andezija. (20. avgust 2009). Aluminijev varnostni list sulfata. [PDF]. Vzeto iz: Andesia.com
- Kemijska knjiga. (2017). Aluminijast sulfat. Vzet od: Kemicalbook.com

