Razvojne rešitve za udarce

- 4339
- 1068
- Ms. Pablo Lebsack
Pojasnjujemo, kakšne so rešitve za blaženje, njihove lastnosti, komponente, vrste in dajejo več primerov
 Raztopine, ki absorbirajo šok, uravnavajo pH okoli določene vrednosti
Raztopine, ki absorbirajo šok, uravnavajo pH okoli določene vrednosti Kaj so rešitve za blaženje?
The Razvojne rešitve za udarce, Prav tako se imenujejo puferji, pH ali regulatorji puferjev, so vodne raztopine, ki jih tvorijo šibka kislina in njegova konjugata.
Imenujejo jih raztopine za amortizer, saj imajo možnost, da po dodatku kislin ali baz v majhnih količinah ublažijo spremembo pH, tudi če gre za močne kisline ali baze.
Raztopine amortizerja so zelo koristne, saj omogočajo, da je pH konstanten. Obstaja veliko kemijskih reakcij, ki potrebujejo specifičen in konstanten pH, da dobro delujejo.
Lastnosti Morpainskih rešitev
So vodne rešitve
Koncept pH in lestvica pH imata smisel le v vodnih raztopinah, zato so vsi puferji ali duševni raztopini pripravljeni v vodi.
Njegovo delovanje temelji na ravnovesju kisline in načel Le Chatlierja
Puferji temeljijo na reakciji reverzibilne kisline/osnovne disociacije, ki so v ravnovesju. Z dodajanjem močnih kislin ali baz v okolje je to ravnovesje moteno, zato sistem reagira na preprečevanje motnje, po načelih Le Catelierja. Tako je Bufers uspel ublažiti velike spremembe v pH.
Vaš pH se zlahka izračuna z enačbo Henderson-Haselbalch
Ne glede na to, kakšno vrsto raztopine absorberja, je pH tako pred in po dodajanju majhnih količin močnih kislin ali baz, ga lahko izračunamo s pomočjo enačbe Henderson-Hohaselbalch:
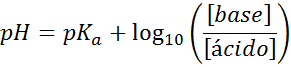
Kjer se [baza] nanaša na molsko koncentracijo baze (ali sol konjugatne baze) in [kislina] se nanaša na molsko koncentracijo kisline (ali soli konjugirane kisline).
Vam lahko služi: elastični materialiLahko delno nevtralizirajo tako kisline kot baze
Raztopine za blaženje so sestavljene iz osnovne snovi in kisle snovi, ki lahko nevtralizira baze in kisline. Zaradi tega lahko ublažijo pH po dodatku močnih kislin in močnih baz.
Njegovo delovanje je odvisno od temperature
PH puferske raztopine je odvisen od kislosti ali osnovne konstante kisline ali šibke podlage, ki jo vsebuje. Ta konstanta je odvisna od temperature, zato je delovanje teh rešitev odvisno tudi od temperature.
Bolj ko koncentriramo, večja je sposobnost blaženja ali uravnavanja pH
Sposobnost dušenja je odvisna od skupne koncentracije raztopine je večja od končne koncentracije kisline ali močne baze, ki se doda. Zaradi tega, večja kot je skupna koncentracija puferske raztopine, večja je sposobnost blazine ali močnih baz.
Komponente dušenja ali puferske raztopine
Kemično raztopine za dušenje tvorijo le dve komponenti. Te komponente so lahko šibka kislina, pomešana s soljo iz njegove konjugatne podlage ali šibka podstavek, pomešana s soljo konjugirane kisline.
Obstajata dva različna načina za pridobitev teh komponent v isti rešitvi, kot bomo videli spodaj:
1. Priprava raztopin za mešanje medpomnilnikov njegovih komponent
To je najbolj neposreden način za pripravo varovalne rešitve. Če želite to narediti, so ločene raztopine šibke kisline (na primer ocetna kislina) in konjugatne osnovne soli (na primer natrijev acetat) pripravljene ločene raztopine). Nato obe rešitvi postopoma mešata do želenega pH.
Lahko vam služi: ionski amonij (NH4+): formula, lastnosti in uporabe
- Raztopine se malo po malo mešajo do želenega pH
2. Priprava puferjev z delno nevtralizacijo raztopine šibke kisline
V tem primeru pripravimo šibko kislinsko raztopino z želeno skupno koncentracijo, nato pa natrij ali kalijev hidroksid dodamo malo le malo, dokler ne dosežemo želenega pH.
Vrste varovalnih rešitev
Rešitve amortizerja šoka lahko razvrstimo glede na vrste komponent, ki jih imajo, ali glede na njihov končni pH.
Glede na vrste komponent:
- Šibek in konjugiran osnovni pufer: V teh primerih je pH odvisen od PKdo šibke kisline.
- Šibek osnovni pufer in konjugirana kislina: V teh primerih je pH odvisen od PKb šibka.
- Poliprotični kislinski pufer: V nekaterih primerih sta vloga šibke kisline in njene konjugatne baze obe soli iz delne nevtralizacije kisline, ki ima več protonov, kot sta žveplova kislina ali fosforna.
Glede na končni ph:
Odvisno od kislosti ali osnovne konstante lahko puferska raztopina uravnava pH okoli različnih pH razponov, kar povzroči tri vrste puferjev:
- Kislinski odbojniki: So tisti, ki uravnavajo pH okoli vrednosti nižje od 7. Pripravljeni so s šibkimi kislinami, katerih PKdo biti manj kot 7 ali s šibkimi osnovami, katerih PKb biti večji od 7.
- Nevtralni puferji: So tisti, ki uravnavajo pH okoli 7. Običajno jih sestavljajo šibke kisline ali baze, ki imajo PKdo ali pkb blizu 7.
- Alkalni medpomnilniki: So tiste, ki uravnavajo pH okoli vrednosti, večje od 7. Pripravljeni so s šibkimi kislinami, katerih PKdo biti večji od 7 ali s šibkimi osnovami, katerih PKb je manj kot 7.
Primeri odbojnikov ali reševalnih rešitev
Pufer ocetne kisline/natrijev acetat
To je pufer šibke kisline (ocetna kislina) in sol njegove konjugatne podlage (natrijev acetat). Vključena ravnovesje in njegova ravnotežna konstanta sta:
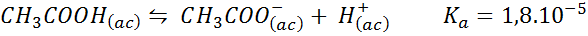
Ta varovalec uravnava pH naokoli 4.74.
Amonijski pufer/amonijev klorid
To je šibek osnovni pufer (amoniak ali amonijev hidroksid) in sol njegove konjugirane kisline (amonijev klorid). Vključena ravnovesje in njegova ravnotežna konstanta sta:
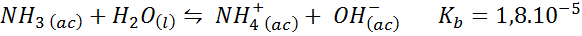
To je alkalni pufer, ki uravnava pH 9.26.
Bisulfat/sulfatni pufer
V tem primeru bisulfatni ion igra papir šibke kisline, katerega konjugata je sulfatna ion. Vključena ravnovesje je:
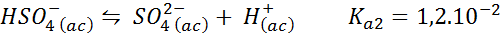
To je kislinska raztopina, ki uravnava pH naokoli 3.05.
Carbon kislina/bikarbonatni pufer
To je eden najpomembnejših sistemov regulacije pH v naši krvi. Vključena reakcija je: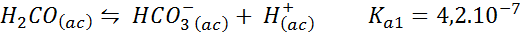
Ta varovalec uravnava pH naokoli 6.38.
Dihidrogenov pufer fosfat/vodikov fosfat
To je eden najbolj uporabljenih sistemov regulacije pH v biologiji in biokemiji, saj omogoča uravnavanje pH zelo blizu fiziološkega pH. Reakcija je:
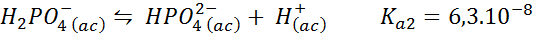
Ta varovalec uravnava pH naokoli 7.20.

