Karakteristike, vrste in selektorji funkcij
- 891
- 179
- Miguel Gutmann DVM
The SelectinAs So družina glikoproteinov, ki jih sestavljajo polipeptidne verige, ki prepoznavajo specifične skladnosti sladkorjev (ogljikovih hidratov), ki se nahajajo na površini drugih celic, in se nanje vežejo. Zaradi tega se imenujejo tudi adhezijske molekule.
Ti adhezijski receptorji so znani po svoji ohranjeni strukturi. Predstavljajo tri domene in tri različne glikoproteine. Lahko se izražajo kot površinske molekule, poleg tega, da so shranjene ali delujoče kot topne molekule.
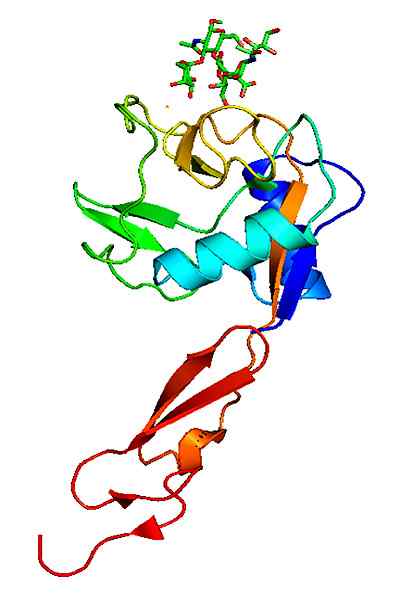
 Molekularna struktura p-selektina. Vzeto in urejeno od: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Molekularna struktura p-selektina. Vzeto in urejeno od: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. V nasprotju z drugimi adhezijskimi molekulami delujejo samo v interakcijah belih krvnih celic z žilnim endotelijem.
[TOC]
Značilnosti
Seleti so vsi beljakovini, ki vsebujejo verižne oligosaharide, združeni s kovalentnimi vezmi na stranske verige aminokislin (glikoproteini). So transmembranske molekule, kar pomeni, da prečkajo lipidni dvolaj.
Imajo značilnosti, ki so zelo podobne beljakovinam CLEC ali lectinas tipa C. Ker kot tipa C lectins, selektinci potrebujejo kalcijeve ione za izvedbo stičišča.
Izvor besede "selectin" se nanaša na dejstvo, da se ti proteini selektivno izražajo v celicah žilnega sistema in vsebujejo tudi domeno lektina.
Nekateri avtorji vključujejo sekine (glikoproteine) znotraj lektinov, ker so molekule, ki se vežejo na sladkorje. Vendar jih drugi avtorji razlikujejo po konceptu, da lektinci prepoznajo le ogljikove hidrate in se jim pridružijo, medtem ko selektorji ne samo prepoznajo in se pridružijo sladkorjem, ampak jih tvorijo tudi ogljikovi hidrati.
Regulacija selektonov se pojavi na ravni transkripcije, s proteolitično obdelavo, s celično klasifikacijo in z reguliranimi izrazi glikozil-transferaz.
Selektorji imajo kratko znotrajcelično domeno. Vendar imajo tri zunajcelične domene, domeno vrste epidermalnega rastnega faktorja, domeno lektinskih tipa C in ponovitev, podobno kot regulativni proteini komplementa.
Vam lahko služi: Hele celice: zgodovina, značilnosti, celični cikel in uporabeFantje
Družina Selectin sestavljajo tri različne vrste glikoproteinov. Vsak od njih je identificiran s pismom, ki označuje kraj, kjer so bili prvič identificirani. Nato bomo videli vsakega od njih.
L-selektin
Znan je tudi kot prodaja, CD62L, LAM1, LEU8, LNHR, LSEL ali TQ1. Najdemo ga v levkocitih, od tod tudi "L" selectin. Je komponenta celične površine. Tri domene so: nasprotnik lektin, faktor epidermalnega rasti in dve soglasju ponovitve.
Predstavlja več ligandov, torej na splošno majhnih molekul, ki tvorijo kompleksne z biomolekulo, v tem primeru protein. Znani ligandi za L-selektin so naslednji.
Glikam1
Znana kot molekula -1 celične adhezije, ki je odvisna od glikozilacije, je proteoglikanski ligand, ki se izraža v post -skokapilarnih venskih vnetjih in omogoča, da se limfociti odpravijo v krvni obtok proti limfoidnim tkivom.
CD34
To je fosfografskoprotein, odkrit v več skupinah sesalcev, kot so človek, podgane in miši. Prvič je bil opisan v hematopoetskih matičnih celicah. Najdemo jih v različnih celicah, vendar je skoraj izključno povezan s hematopoetiko.
Madcam-1
Znana kot molekula adhezije AD ali celične adhezije v smeri vaskularne sluznice (v angleščini, vaskularna sluznica adhezijska molekula 1). Gre za zunajcelični protein endotelija, ki je odgovoren za določitev, v katerem tkivo bodo vstopili limfociti, poleg tega, da nosijo sladkor, tako da jih prepozna L-selektin.
PSGL-1
Med drugimi sinonimi, kot sta SelPlG ali CD162, je glikoprotein, ki ga najdemo v endotelnih celicah in v levkocitih. Pridružite se lahko drugi dve vrsti selekcij. Vendar se zdi, da predstavlja boljšo afiniteto s P-selektinom.
Vam lahko služi: glivične celice: značilnosti, organele in funkcijeP-selektin
P-selektin poznata druga imena, kot so SELP, CD62, CD62P, GMP140, GRMP ali LECAM3. Nahaja se na površini endotelijskih celic, ki pokrivajo notranje robove krvnih žil in trombocitov.
P-selektin je bil prvič identificiran v trombocitih. Zato ime proteina nosi začetni "P".
Struktura P-selektina je sestavljena iz domene, ki je zelo podobna lektinu tipa C na koncu n EGF; torej ohranjena beljakovinska domena od približno 30 do 40 aminokislinskih odpadkov z dvokasežnim β listom, ki ji sledi zanka do kratkoročnega bikatenarnega β-terminalnega lista.
Predstavlja tretji doming, podoben dopolnjevanju beljakovin, ki se imenuje domena, na primer domena Cub, za katero je značilno, da je evolucijsko ohranjena beljakovinska domena in predstavitev približno 110 aminokislinskih odpadkov.
Ligand z večjo afiniteto P-selektina je PSGL-1, kot je bilo predhodno opisano v L-selektinskih ligandih. Po drugi strani lahko ta protein tvori tudi komplekse z drugimi molekulami, kot sta sulfatirani polisaharid, imenovan fukoidan in heparán sulfat.
E-selektin
Ta selekcijski protein je znan tudi po naslednjih imenih: Sele, CD62E, ELAM, ELAM1, ESEL, LECAM2 in drugi. Izraža se izključno v endotelnih celicah, ki jih aktivirajo majhni proteini, ki ne morejo prečkati lipidnega dvosloja celice, imenovane citokini.
Struktura tega proteina je sestavljena iz treh domen (na primer preostalih seketincev): domene, podobne EGF, 6 enotami kontrolnih beljakovinskih modulov (imenovanih tudi suši domene) ponovitve SCR in transmembranske domene.
Lahko vam služi: megakariociti: značilnosti, struktura, tvorba, zorenje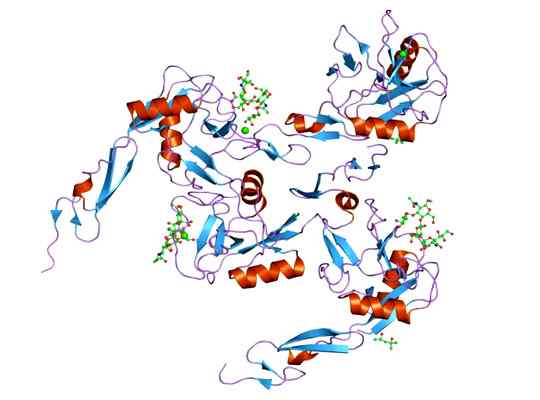 Predstavitev molekularne strukture proteina E-selektina, katerega domino je EGF. Vzeto in urejeno od: Jawahar Swaminathan in MSD osebje na evropskem inštitutu za bioinformatiko [javna domena].
Predstavitev molekularne strukture proteina E-selektina, katerega domino je EGF. Vzeto in urejeno od: Jawahar Swaminathan in MSD osebje na evropskem inštitutu za bioinformatiko [javna domena]. Ligand, ki tvori komplekse z e-selektivnim, je precej raznolik, toda tisti, ki izstopajo, so naslednji.
Siallyl-lewis a
Imenuje se tudi SLE A O CA19-9. To je tetrasaharid pri serumih bolnikov z rakom. Znano je, da sodeluje v procesu prepoznavanja celičnih celic. Konstitutivno se izraža v granulocitih, monocitih in limfocitih t.
Siallyl-Lewis x
Je tudi tetratasaharid, kot je Siallyl-Lewis A in ima podobne funkcije. Izražena je v granulocitih in monocitih in nadzoruje neželen izhod ali puščanje teh celic med vnetjem.
PSGL-1
Čeprav je očitno učinkovitejši pri P-selektinu, nekateri avtorji menijo, da je oblika, ki izhaja iz človeškega nevtrofila, tudi pri e-selektinu precej učinkovita. Pravzaprav menijo, da je na splošno ta ligand temeljni za tri vrste selektonov.
Delovanje
Glavna funkcija selekcij je del procesa tvorbe belih krvnih celic (limfociti). Sodelujejo tudi v imunskem odzivu, v kroničnih in akutnih vnetjih v različnih organih telesa, kot so ledvice, srce in koža. Delujejo celo v vnetnih procesih rakotvornih metastaz.
Reference
- Selectin. Pridobljeno iz: v.Wikipedija.org.
- L-selektin. Pridobljeno iz: v.Wikipedija.org.
- CA19-9. Pridobljeno iz: v.Wikipedija.org.
- E-selektin. Pridobljeno iz: v.Wikipedija.org.
- X. ZOU, v.R. Shinde Patil, n.M. Dagia, l.Do. Smith, m.J. Wargo, k.Do. Interliggi, c.M. Lloyd, d.F. Tees, b. Walcheck, m.B. Lawrence, d.J. Goetz (2005). PSGL-1, ki izhaja iz človeških nevtrofilcev, je visoko učinkovit ligand za e-selectin edotelij-ekspresije pod tokom. Ameriški časopis za fiziologijo. Celična fiziologija.
- K. Zakon (2001). Funkcije seketincev. Rezultati in težave pri diferenciaciji celic.
- SelectinAs. Okreval od: WellPath.Uniovi.je.
- J.H. Pérez & C.J. Montoya. Adhezijske molekule. Pridobljeno iz: Encolombia.com.
- Do.C. Sanguineti in J.M Rodríguez-Tafur (1999). Molekule adhezije in kože. Perujska dermatologija.
- T.F. Tedder, d.Do. Steeber, a. Chen, str. Engel (1995). Seleksinci: žilne adhezijske molekule. Časopis FASEB.
- « Značilnosti bele mangrove, habitat, taksonomija, uporablja
- Značilnosti, strukture in funkcije integracije »

