Karakteristike kemičnih reakcij, deli, tipi, primeri

- 4186
- 713
- Dexter Koch
The Kemične reakcije Gre za spremembe, ki trpijo pri naročanju njihovih atomov in se zgodijo, ko v stik prideta dve različni snovi ali spojine. V postopku spremembah, ki jih je mogoče takoj zaznati; na primer zvišanje temperature, hlajenja, tvorbe plina, utripa ali padavine trdne snovi.
Najpogostejše kemijske reakcije v vsakdanjem življenju pogosto ostanejo neopažene; Na tisoče jih je izvedenih v naših telesih. Drugi pa so bolj vidni, saj jih lahko izvajamo v kuhinji z izbiro pravilnih pripomočkov in sestavin; Na primer, bikarbonat zmešajte s kisom, mešanico sladkorja v vodi ali zakisajte sok Kolorada.
 Reakcija bikarbonata in kisa je primer ponavljajoče se kemijske reakcije v kuhinji. Vir: Kate Ter Har (https: // www.Flickr.com/fotografije/Katerha/5703151566)
Reakcija bikarbonata in kisa je primer ponavljajoče se kemijske reakcije v kuhinji. Vir: Kate Ter Har (https: // www.Flickr.com/fotografije/Katerha/5703151566) V laboratorijih kemične reakcije postanejo bolj običajne in pogoste; Vsi se pojavljajo znotraj čaše (čaše) ali bučke Erlenmeyer. Če si skupno delijo, nobena ni preprosta, ker skrivajo trke, prekinitve povezav, mehanizme, oblikovanje povezav, energijo in kinetične vidike.
Obstajajo kemijske reakcije tako presenetljive, da jih oboževalci in znanstveniki, ki poznajo toksikologijo reagentov in nekatere varnostne ukrepe.
[TOC]
Koncept kemijske reakcije
Kemične reakcije potekajo, ko pride do prekinitve povezave (ionskega ali kovalentnega), tako da se na mestu oblikuje druga; Dva atoma ali nabor od njih nehata močno komunicirati, da bi povzročila nove molekule. Zahvaljujoč temu je mogoče določiti kemijske lastnosti spojine, njegovo reaktivnost, stabilnost s tem, kar reagira.
Poleg tega, da so odgovorni, kemične reakcije, ki jih zadeva nenehno spreminja, brez njihovih atomov, pojasnjujejo nastanek spojin, kot jih poznamo.
Da se povezave porušijo, je potrebna energija, in ko se oblikujejo povezave, se sprosti. Če je absorbirana energija večja od sproščene, pravijo, da je reakcija endotermalna; Imamo okoliško hlajenje. Medtem ko je sproščena toplota boljša od absorpcije, bo to eksotermična reakcija; Okolica je segreta.
Značilnosti kemijskih reakcij
Kinetika
Teoretične molekule morajo sodelovati med seboj, pri čemer je z njimi dovolj kinetične energije, da lahko nakloni razbijanje povezave. Če so vaši trki počasni ali neučinkoviti, je kinetično prizadeta kemična reakcija. To se lahko zgodi bodisi s fizičnimi stanji snovi ali z geometrijo ali strukturo istega.
Tako se v reakciji zadeva preoblikuje z absorpcijo ali sproščanjem toplote, hkrati pa trpi trke, ki so naklonjeni oblikovanju izdelkov; Najpomembnejše sestavine kakršne koli kemijske reakcije.
Ohranjanje množice
Zaradi zakona o ohranjanju mase skupna masa niza ostane konstantna po kemični reakciji. Tako je vsota posameznih mas vsake snovi enaka masi dobljenega rezultata.
Fizične spremembe in/ali spremembe stanja
Pojav kemijske reakcije lahko spremlja sprememba stanja komponent; to je variacija trdnega, tekočega ali plinastega stanja materiala.
Vendar vse spremembe v stanju ne pomenijo kemične reakcije. Na primer: Če voda izhlapi zaradi toplote, vodna para, ki nastane po tej spremembi stanja, ostane voda.
Barvna variacija
Med fizikalnimi atributi, ki so posledica kemijske reakcije, sprememba barve reagentov v primerjavi z barvo končnega izdelka izstopa.
Ta pojav je opazen pri opazovanju kemične reakcije kovin s kisikom: ko je kovina oksidirano.
Sproščanje plina
Ta značilnost se kaže kot mehurček ali z emisijo določenih vonjav.
Na splošno se mehurčki pojavijo kot posledica predložitve tekočine pri visokih temperaturah, kar spodbuja povečanje kinetične energije molekul, ki so del reakcije.
Temperaturne spremembe
V primeru, da je toplota katalizator kemične reakcije, bo v končnem izdelku sprožena temperaturna sprememba. Zato sta lahko vnos toplote in izstop v postopku značilna tudi za kemične reakcije.
Deli kemične reakcije
Reagenti in izdelki
Vsaka kemična reakcija je predstavljena z enačbo tipa:
A + B → C + D
Kjer sta A in B reaktanta, medtem ko C in D. Enačba nam pove, da atom ali molekula A reagira z B, da povzroči produkte C in D. To je nepovratna reakcija, saj reaktanti ne morejo izvirati iz produktov. Namesto tega je spodnja reakcija reverzibilna:
A + B C + D
Pomembno je poudariti, da mora biti masa reaktantov (A+B) enaka masi produktov (C+D). V nasprotnem primeru testo ne bi bilo ohranjeno. Prav tako mora biti število atomov za dani element enako pred in po puščici.
Nad puščico kaže na nekatere specifikacije reakcije: temperatura (δ), pojavnost ultravijoličnega sevanja (Hv) ali uporabljeni katalizator.
Vam lahko postreže: steklo ureReakcija pomeni
Glede na življenje in reakcije, ki se pojavljajo v naših telesih, je medij reakcije vodni (AC). Vendar pa se lahko kemične reakcije razvijejo v katerem koli tekočem mediju (etanol, ledena ocetna kislina, toluen, tetrahidrofuran itd.), dokler se reagenti dobro raztopijo.
Zabojnike ali reaktorje
Nadzorovane kemijske reakcije se pojavljajo v posodi, naj bo to preprost stekleni material ali v reaktorju iz nerjavečega jekla.
Vrste kemijskih reakcij
Vrste kemijskih reakcij temeljijo na dogajanju na molekularni ravni; Kakšne povezave se zlomijo in kako se atomi na koncu pridružijo. Upošteva se tudi, ali vrste pridobivajo ali izgubijo elektrone; tudi ko se to zgodi v večini kemičnih reakcij.
Tu so različne vrste kemičnih reakcij, ki obstajajo.
- Oksidacijsko zmanjšanje (Rédox)
Oksidacija bakra
V primeru patine poteka oksidacijska reakcija: kovinski baker izgubi elektrone v prisotnosti kisika, da se pretvori v ustrezen oksid.
4CU (s) + o2(g) => cu2Ti)
Bakreni oksid (I) še naprej oksidira, da daje bakreni oksid (II):
2CU2Ali (s) + oz2 => 4CUO (S)
Ta vrsta kemijske reakcije, pri kateri vrste povečujejo ali zmanjšajo njihovo oksidacijsko število (ali status), je znana kot oksidacija in redukcijska reakcija (Rédox).
Kovinski baker z oksidacijskim stanjem 0 najprej izgubi elektron, nato pa drugega (oksidira), medtem ko kisik ostane (zmanjša se):
Cu => cu+ + in-
Cu+ => Cu2+ + in-
Tudi2 + 2e- => 2nd2-
Dobiček ali izguba elektronov je mogoče določiti z izračunom oksidacijske številke za atome v kemičnih formulah njihovih dobljenih spojin.
Za Cu2Ali pa je znano, da ima anion ali2-, Torej, da ohranite nevtralizirane obremenitve, mora imeti vsak od obeh bakrenih atomov +1 obremenitev. Zelo podobno se zgodi s cuo.
Baker, ko oksidira pridobi pozitivne oksidacijske številke; in kisik, ki ga je treba zmanjšati, negativne oksidacijske številke.
Železo in kobalt
Spodaj so prikazani dodatni primeri za reakcije. Prav tako bo podan kratek komentar in določene bodo spremembe oksidacijskih številk.
FECL2 + Cocl3 => FECL3 + Cocl2
Če se izračunajo oksidacijske številke, je treba ugotoviti, da tisti iz CL ostanejo s konstantno vrednostjo -1; Ni tako, z vero in co.
Na prvi pogled se je železo oksidiralo, medtem ko se kobalt zmanjšuje. Kako vedeti? Ker železo zdaj ne sodeluje z dvema CL- Toda s tremi je najbolj elektronegativni atom klora kot železo in kobalt. Po drugi strani pa se zgodi nasprotno s kobaltom: gre od interakcije s tremi Cl- dvema od njih.
Če prejšnje sklepanje ni jasno, so napisane kemijske enačbe neto prenosa elektronov:
Vera2+ => Vera3+ + in-
Co3+ + in- => Co2+
Zato vera2+ Oksidira, medtem ko je co3+ je zmanjšan.
Jod in mangan
6kmno4 + 5Ki + 18HCl => 6mncl2 + 5Kio3 + 6KCl+ 9h2Tudi
Kemikacija zgoraj se morda zdi zapletena, vendar ni. Klor (cl-) ne kisik (ali2-) Izkušnje z dobičkom ali izgubo svojih elektronov. Jod in mangan, ja.
Glede na samo spojine z jodom in manganom imate:
Ki => Kio3 (Oksidacijska številka: -1 do +5, izgubi šest elektronov)
Kmno4 => Mcl2 (Oksidacijska številka: +7 do +2, osvoji pet elektronov)
Jod oksidira, medtem ko se mangan zmanjša. Kako vedeti brez izračuna? Ker jod prehaja od kalija do interakcije s tremi kisik (bolj elektronegativno); Medtem mangan izgubi interakcije s kisikom, da bi bili s klorom (manj elektronegativnega).
Ki ne more izgubiti šest elektronov, če kmno4 Zmaga pet; Zato mora biti število elektronov v enačbi uravnoteženo:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5E- => Mcl2)
Kar povzroča neto prenos 30 elektronov.
Izgorevanje
Izgorevanje je živahna in energična oksidacija, v kateri se sproščata svetloba in toplota. Na splošno pri tej vrsti kemijske reakcije kisik sodeluje kot oksidacijsko ali kombinirajočo sredstvo; Medtem ko je reducirajoče sredstvo gorivo, ki gori na koncu računa.
Kjer je pepel, je bilo zgorevanje. Ti so sestavljeni iz premoga in kovinskih oksidov; Čeprav je njegova sestava logično odvisna od tega, kaj je gorivo. Spodaj je nekaj primerov:
C (s) + o2(g) => co2(g)
2co (g) + oz2(g) => 2co2(g)
C3H8(g) + 5o2(g) => 3CO2(g) + 4h2O (g)
Vsaka od teh enačb ustreza popolnim izgonom; to pomeni, da vse gorivo reagira s presežkom kisika, da zagotovi popolno preobrazbo.
Treba je tudi opozoriti, da je co2 in h2Ali pa so proizvodi iz plinaste večine, ko gorejo gazirana telesa (na primer les, ogljikovodiki in živalska tkiva). Neizogibno je, da se zaradi kisikove insuficience oblikuje nekaj alotropnih premoga, pa tudi manj kisikovih plinov, kot sta CO, in ne.
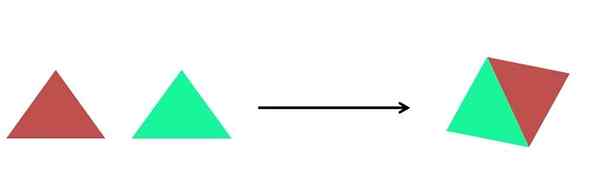
- Sinteza
 Grafični prikaz sinteze reakcije. Vir: Gabriel Bolívar.
Grafični prikaz sinteze reakcije. Vir: Gabriel Bolívar. Na vrhunski sliki je prikazana zelo preprosta reprezentacija. Vsak trikotnik je spojina ali atom, ki se združi, da tvori eno samo spojino; Dva trikotnika tvorita paralelogram. Mase se povečujejo in fizikalne in kemijske lastnosti izdelka se pogosto zelo razlikujejo od lastnosti njihovih reagentov.
Vam lahko služi: entalpijaNa primer, zgorevanje vodika (ki je tudi Rédox Reakcija), proizvaja hidrid vodikovega oksida ali kisika; bolj znan kot Agua:
H2(g) + oz2(g) => 2H2O (g)
Z mešanjem obeh plinov pri visoki temperaturi izgorevate plinasto vodo. Ohlajene temperature, hlapi kondenzirajo, da dajo tekočo vodo. Več avtorjev meni, da je ta reakcija sinteze ena od možnih alternativ za nadomeščanje fosilnih goriv pri pridobivanju energije.
Povezave H-H in O = O sta porušeni, da tvorita dve novi preprosti povezavi: H-O-H. Voda, kot je dobro znana, je neprimerljiva snov (zunaj romantičnega smisla), njegove lastnosti pa se precej razlikujejo od plinastega vodika in kisika.
Ionske spojine
Nastajanje ionskih spojin iz njegovih elementov je tudi primer reakcije sinteze. Eden najpreprostejših je tvorba kovinskih halgenuros skupin 1 in 2. Na primer sinteza kalcijevega bromida:
Ca (s) + br2(L) => Cabr2(S)
Splošna enačba za to vrsto sinteze je:
M (s) + x2 => Mx2(S)
Koordinacija
Ko oblikovana spojina vključuje kovinski atom znotraj elektronske geometrije, se reče, da gre za kompleks. V kompleksih kovine ostanejo združene z ligand s šibkimi kovalentnimi vezmi in se tvorijo z koordinacijskimi reakcijami.
Na primer, imate kompleks [CR (NH3)6]3+. To se oblikuje, ko je pripadnik3+ je v prisotnosti molekul amonijaka, NH3, ki delujejo kot kromirani ligandi:
Cr3+ + 6nh3 => [CR (NH3)6]3+
Spodaj je nastali koordinacijski oktaedro okoli kromiranega kovinskega centra:
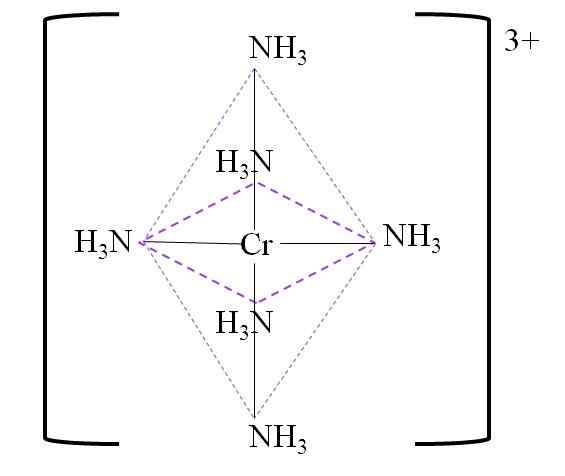 Koordinacijski oktaedron za kompleks. Vir: Gabriel Bolívar.
Koordinacijski oktaedron za kompleks. Vir: Gabriel Bolívar. Upoštevajte, da obremenitev kroma 3+ v kompleksu ni nevtralizirana. Njegova barva je vijolična in zato je oktaedron predstavljen z omenjeno barvo.
Nekateri kompleksi so bolj zanimivi, kot v primeru nekaterih encimov, ki koordinirajo atome železa, cinka in kalcija.
- Razgradnja
Razgradnja postane nasprotno od sinteze: spojina se razbije v en, dva ali tri elemente ali spojine.
Na primer, obstajajo naslednje tri razgradnje:
2HGO (S) => 2HG (L) + O2(g)
2H2Tudi2(L) => 2H2Ali (l) + o2(g)
H2Co3(ac) => co2(g) + h2Ali (l)
HGO je rdečkasta trdna snov, ki se s toplotno akcijo vdre v kovinsko živo srebro, črno tekočino in kisik.
Vodikov vodikov peroksid trpi razgradnjo, kar daje tekočo vodo in kisik.
In medtem ogljikova kislina razpade v ogljikovem dioksidu in tekoči vodi.
Bolj "suha" razgradnjo je tisti, ki ga trpijo kovinski karbonati:
Tat3(s) => cao (s) + co2(g)
Razred vulkan
 Pohištveni amonijev dikromat vulkan. Vir: natak [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Pohištveni amonijev dikromat vulkan. Vir: natak [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Reakcija razgradnje, ki je bila uporabljena v kemijskih razredih, je toplotna razgradnja amonijevega dikromata (NH4)2Cr2Tudi7. Ta oranžna karkanogenalna sol (zato je treba ravnati z veliko previdnostjo), gori, da sprosti veliko toplote in ustvari zeleni trdni, kromični oksid, CR2Tudi3:
(NH4)2Cr2Tudi7(s) => cr2Tudi3(s) + 4h2Ali (g) + n2(g)
- Premik
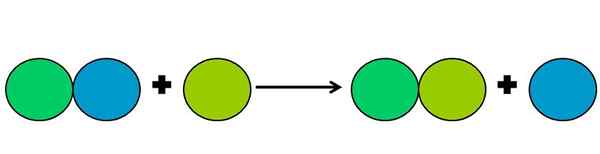 Grafični prikaz reakcije premika. Vir: Gabriel Bolívar.
Grafični prikaz reakcije premika. Vir: Gabriel Bolívar. Reakcije premika so vrsta reakcijskega rédoksa, v katerem en element izpodriva drugega v spojino. Razseljeni element konča zmanjšanje ali pridobivanje elektronov.
Za poenostavitev zgornjega je prikazana zgornja slika. Krogi predstavljajo element. Opazimo, da Lima Green Circle izpodriva modro, saj je na zunanji strani; Ampak ne samo to, ampak se modri krog v procesu zmanjša in je zelena lima oksidirana.
Vodika
Na primer, naslednje kemijske enačbe za izpostavitev zgoraj:
2al (s) + 6HCl (AC) => alcl3(AC) + 3H2(g)
Zr (s) + 2h2Ali (g) => zro2(s) + 2h2(g)
Zn (s) + h2SW4(AC) => ZnSO4(Ac) + h2(g)
Kakšen je razseljen element za te tri kemične reakcije? Vodik, ki se zmanjša na molekularni vodik, h2; prehaja od oksidacijske številke +1 do 0. Upoštevajte, da kovine aluminija, cirkonija in cinka lahko izpodrinejo vodike kislin in vode; Medtem ko baker, srebro ali zlato ne morejo.
Kovine in halogena
Prav tako sta na voljo ti dve dodatni reakciji premika:
Zn (s) + cuo4(ac) => cu (s) + Znso4(AC)
Cl2(g) + 2nai (ac) => 2nacl (ac) + i2(S)
V prvi reakciji cink preseli manj aktivni kovinski baker; Cink oksidira, medtem ko se baker zmanjša.
V drugi reakciji na drugi strani klor, bolj reaktivni element kot jod. Tukaj se zgodi nazaj: najbolj reaktivni element se zmanjša z oksidacijo razseljenega elementa; Zato je klor zmanjšan oksidacija na joda.
- Tvorba plina
V reakcijah je bilo razvidno, da je več od njih ustvarilo pline, zato vstopajo tudi v to vrsto kemijske reakcije. Prav tako se reakcije prejšnjega odseka, premik vodika z aktivno kovino, štejejo za reakcije tvorbe plina.
Vam lahko služi: dodecil natrijev sulfat (SDS): struktura, lastnosti, uporabePoleg že omenjenih kovinskih sulfidov, na primer sprosti vodikov sulfid (ki diši po gnilo jajci), ko dodamo klorovodikovo kislino:
Na2S (s) + 2HCl (AC) => 2Nacl (AC) + H2S (g)
- Metaheza ali dvojni premik
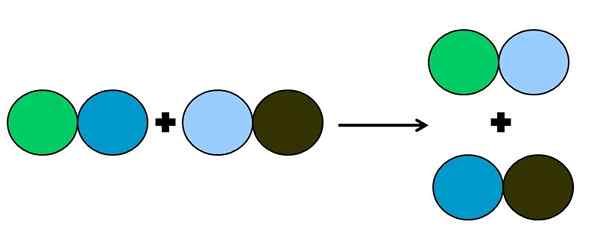 Grafični prikaz dvojne reakcije. Vir: Gabriel Bolívar.
Grafični prikaz dvojne reakcije. Vir: Gabriel Bolívar. Pri reakciji metateze ali dvojnega premika se zgodi sprememba parov brez prenosov elektronov; Se pravi, da se ne šteje za reakcijsko rédox. Kot je razvidno iz zgornje slike, se zeleni krog lomi s tem, da je temno modra povezava s svetlo modrim krogom.
Padavine
Ko so interakcije enega od parov dovolj močne, da premagajo učinek reševanja tekočine, dobimo oborino. Naslednje kemijske enačbe predstavljajo reakcije padavin:
Agno3(AC) + NaCl (AC) => Agcl (S) + Nano3(AC)
Cacl2(Ac) + na2Co3(ac) => caco3(s) + 2Nacl (AC)
V prvi reakciji Cl- izpodriva št3- Za tvorbo srebrnega klorida Agcl, ki je bela oborina. In v drugi reakciji, co32- izpodriva CL- Za oborino kalcijevega karbonata.
Osnovna kislina
Morda je najbolj emblematična reakcij metahaneze, ki je nevtralizacijska osnovna kislina. Končno sta primeri prikazani dve reakciji osnovne kisline:
HCl (AC) + NaOH (AC) => NACl (AC) + H2Ali (l)
2HCl (AC) + BA (OH)2(Ac) => bacl2(AC) + 2H2Ali (l)
Oh- Se preselijo v CL- Oblikovati vodo in kloridne soli.
Primeri kemijskih reakcij
Spodaj in potem bodo omenili nekatere kemične reakcije z ustreznimi enačbami in komentarji.
Premik
Zn (s) + agno3(AC) → 2AG (S) + Zn (št3)2(AC)
Cink izpodriva srebro v svoji nitratni soli: zmanjšuje AG+ Ag. Kot rezultat, se kovinsko srebro začne obogatiti na sredini, opažen na mikroskopu, ki je srebrna drevesa. Po drugi strani je nitrat kombiniran z ioni Zn2+ ki nastane za oblikovanje cinkovega nitrata.
Nevtralizacija
Tat3(s) + 2HCl (AC) → CACL2(Ac) + h2Ali (l) + co2(g)
Klorovodikova kislina nevtralizira kalcijevo karbonatno sol, da nastane sol, kalcijev klorid, vodo in ogljikov dioksid. Co2 mehurčki in se odkrijejo v vodi. Ta mehur3.
Nh3(g) + hcl (g) → nh4Cl (s)
V tej drugi reakciji HCL hlapi nevtralizirajo plinasti amoniak. Solni amonijev klorid, NH4CL, tvori kot belkast dim (spodnja slika), saj vsebuje zelo drobne delce, suspendirane v zraku.
 Reakcija treninga amonijevega klorida. Vir: Adam Rędzikowski [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Reakcija treninga amonijevega klorida. Vir: Adam Rędzikowski [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Dvojni premik
Agno3(AC) + NaCl (AC) → AGCL (S) + Nano3(AC)
V reakciji z dvojnim premikom obstaja izmenjava "parov". Silver spremeni par z natrijem. Rezultat tega je, da se nova sol, srebrni klorid, agcl, obori kot mlečna trdna.
Rédox
 V kemijskem reakcijskem lajenju se sproščajo pasja toplota, zvok in modra svetloba. Vir: Maxim Bilovitskiy prek Wikipedije.
V kemijskem reakcijskem lajenju se sproščajo pasja toplota, zvok in modra svetloba. Vir: Maxim Bilovitskiy prek Wikipedije. Obstaja nešteto reakcij Rédox. Eden najbolj impresivnih je, da je Barkin Dog:
8 n2Ali (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(g)
Sproščena energija je toliko, ko nastanejo trije stabilni izdelki, da je modrikast bliskavico (nadrejena slika) in odmevno povečanje tlaka, ki ga povzročajo plini (CO2 in n2).
In poleg tega vse to spremlja zelo močan zvok, podoben lajanju psa. Proizvedeni žveplo, s8, Pokrijte rumene notranje stene cevi.
Katera vrsta je zmanjšana in katere oksidira? Na splošno imajo elementi oksidacijsko številko 0. Zato morata biti žveplo in dušik v izdelkih vrsta, ki je pridobila ali izgubila elektrone.
Žveplo oksidirano (izgubljeni elektroni), saj je imel oksidacijsko številko -2 v CS2 (C4+S22-)::
S2- → s0 + 2e-
Medtem ko se je dušik zmanjšal (osvojil elektrone), ker je imel oksidacijsko številko +1 v n2Ali (n2+Tudi2-)::
2N+ + 2e → n0
Rešene vaje za kemijske reakcije
- Vaja 1
Kaj sol obori v naslednji reakciji v vodnem mediju?
Na2S (AC) + FESO4(Ac) →?
Na splošno praviloma vsi sulfidi, razen oblikovanih z alkalnimi in amonijevimi kovinami, oborimo v vodnem mediju. Pojavi se dvojni premik: železo se veže na sulfid in natrij s sulfatom:
Na2S (AC) + FESO4(AC) → FES (S) + NA2SW4(AC)
- Vaja 2
Katere izdelke bomo dobili od naslednje reakcije?
Žig3)2 + CA (OH)2 →?
Kalcijev hidroksid v vodi ni zelo topen; Toda dodajanje bakrenega nitrata ga pomaga solubizirati, ker reagira tako, da tvori ustrezen hidroksid:
Žig3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (št3)2(AC)
Cu (OH)2 Takoj je prepoznan, da je modra oborina.
- Vaja 3
Kakšna sol se bo pojavila v naslednji reakciji nevtralizacije?
Al (OH)3(s) + 3HCl (AC) → ¿¿?
Aluminijev hidroksid se obnaša kot baza, ki reagira s klorovodikovo kislino. V reakciji nevtralizacije kisline (iz Brnsted-Lowry) se vedno tvori, zato mora biti drugi produkt aluminijev klorid, alcl3:
Al (OH)3(s) + 3HCl (AC) → Alll3(AC) + 3H2Tudi
Tokrat alcl3 Ne obori, ker je sol (do neke mere) topna v vodi.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Ana Zita. (18. november 2019). Kemične reakcije. Okrevano od: Todamateria.com
- Kashyap Vyas. (23. januar 2018). 19 kul kemijskih reakcij, ki jih proč znanosti spopadajo. Okrevano od: zanimivo dengineering.com
- Lepihemistry.neto (s.F.). Reakcija. Okrevano od: Beautifulchemistry.mreža
- Wikipedija. (2019). Kemijska reakcija. Pridobljeno iz: v.Wikipedija.org

