Eksotermične in endotermične reakcije
- 911
- 222
- Percy Feeney
 Izgorevanje je primer eksotermične reakcije, saj sprošča toploto. Led se topi skozi endotermično reakcijo, saj zahteva toplotno energijo
Izgorevanje je primer eksotermične reakcije, saj sprošča toploto. Led se topi skozi endotermično reakcijo, saj zahteva toplotno energijo The eksotermične in endotermične reakcije Razlikujejo se v dejstvu, da je toplotna energija prvega sproščanja, medtem ko jo slednja absorbira, glede na spremembe toplote, ki se pojavijo med kemičnimi reakcijami.
Podobno so lahko v kemijske reakcije vključene druge vrste energije, saj včasih med reakcijo, svetlobna energija, zvočna energija in celo elektrika nastajajo.
Upoštevati ne samo toplote, ampak tudi druge vrste energije, kemične reakcije so razvrščene kot Exergonic in Endermanics. Exergonična reakcija sprosti energijo, ko jo proizvajajo, medtem ko jo endogonski absorbira.
V tem primeru je eksotermična reakcija tudi Exergonic Reakcija, saj sprošča toploto. Eden najbolj znanih primerov je izgorevanje. Vsakič, ko se košček lesa zgore, se sprosti kalorična in svetla energija.
Po drugi strani pa se pri topinju kocke na ledu pojavi ena najbolj znanih kemičnih reakcij, saj led absorbira toplotno energijo okolja, da se preoblikuje v tekočo vodo.
Eksotermična reakcija se lahko pojavi spontano, čeprav morate včasih opraviti nekaj dela. Vendar pa je za endotermično reakcijo vedno potrebno, da okolje opravi delo v sistemu.
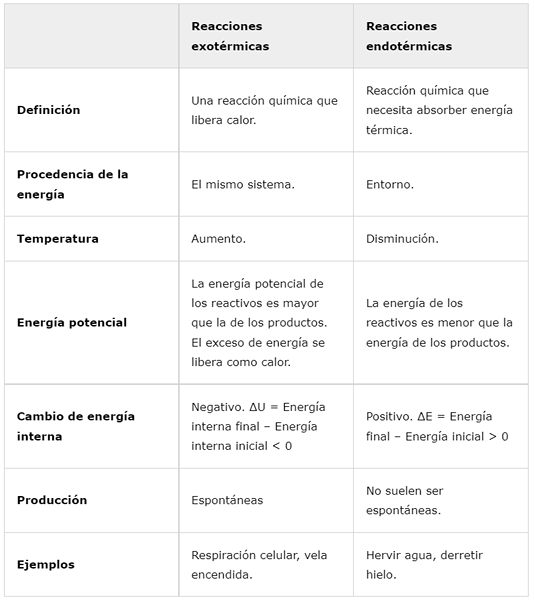
Eksotermične reakcije | Endotermične reakcije | |
Opredelitev | Kemična reakcija, ki sprošča toploto. | Kemična reakcija, ki mora absorbirati toplotno energijo. |
Izvor energije | Isti sistem. | Okoli. |
Temperatura | Porast. | Zmanjšati. |
Potencialna energija | Potencialna energija reagentov je večja kot pri izdelkih. Odvečna energija se sprosti kot toplota. | Energija reagentov je manjša od energije izdelkov. |
Notranja sprememba energije | Negativno. ΔU = končna notranja energija - začetna notranja energija < 0 | Pozitivno. ΔE = končna energija - začetna energija> 0 |
Proizvodnja | Spontano | Običajno niso spontani. |
Primeri | Celično dihanje, gorečo svečo. | Zavremo vodo, tali led. |
Eksotermične reakcije
Opredelitev
Vrsta kemične reakcije, ki sprošča toploto, ko se izvaja.
Lahko vam služi: cikloheksen: struktura, lastnosti, sinteza in uporabeIzvor energije
Isti sistem zagotavlja energijo, tako da pride do reakcije.
Temperatura
Po reakciji je a porast temperature.
Potencialna energija
Ko pride do kemijske reakcije med reagenti, se med njimi lonijo povezave in druge se oblikujejo za ustvarjanje novih molekul. Toda vse povezave ne združujejo atome in molekule z isto silo, zato je energija za razbijanje ali ustvarjanje vsake povezave drugačna.
Med vsako reakcijo se zlomijo in ustvarijo različno število povezav, zato je energija drugačna. V eksotermični reakciji potencialna energija reagentov je starejši kot proizvoda in ker je energija ohranjena, se presežek sprosti kot toplota.
Notranja sprememba energije
Notranja energija je povezana s sposobnostjo sistema za opravljanje dela in vključuje njegovo potencialno in kinetično energijo. Absolutna energija sistema ni določena, ampak njegova variacija, imenovana ΔU.
Glede na to, kar je bilo rečeno v prejšnjem razdelku, je sprememba notranje energije ΔU negativna.
ΔU = končna notranja energija - začetna notranja energija < 0
Proizvodnja
Večina eksotermičnih reakcij je spontano, to pomeni, da se odvijajo sami, ne da bi morali dodati zunanjo energijo, dokler se reagenti ne izčrpajo.
Primeri
Običajno so oksidacijske reakcije in tiste, ki vodijo do tvorbe spojin, običajno eksotermične reakcije:
1. Raztopi detergent v vodi
Pri raztapljanju oblačil prahu v malo hladni vodi se počuti toplo, ko se ga dotakne.
2. Celično dihanje
Pri živalih in rastlinah se proces celičnega dihanja izvaja kot del ogljikovega cikla. Dihanje uporablja glukozo in kisik za vrnitev ogljikovega dioksida, vode in energije v skladu z reakcijo:
Vam lahko služi: titanov oksid (iv): struktura, lastnosti, uporabeC6H12Tudi6 + 62 → 6CO2 + H2O + Energy (ATP)
3. Pereča sveča
Poleg svetlobe pekoča sveča oddaja toploto in druge snovi:
Kisik kisik → voda + ogljikov dioksid + svetloba in toplota
4. Bombardirani hrošč
Ta žuželka se brani s škropljenjem aerosola o svojih plenilcih. Hrošči hranijo tekočine in encime v ločenih oddelkih, ki se nahajajo v trebuhu.
Ko je ogrožena, izteče tekočine proti predelu encima in nastaja kemična reakcija, ki ustvarja paro in toploto, ki deluje kot repelent za morebitne plenilce.
5. Jeklena in kis volna
Kovina, kot je železo, se počasi oksidira pri reakciji z okoljem, če pa kis doda malo jeklene volne.
Endotermične reakcije
Opredelitev
Reakcije, v katerih morajo reagenti absorbirati toplotno energijo, tako da dobimo izdelke.
Izvor energije
Energija, potrebna za izvedbo reakcije, iz okolja.
Temperatura
Endotermična reakcija pomeni a zmanjšati temperature.
Potencialna energija
Za razliko od tega, kar se zgodi z eksotermično reakcijo, energijo reagentov Manj je da je energija izdelkov.
Notranja sprememba energije
V endotermični reakciji je sprememba notranje energije ΔE pozitivna.
ΔE = končna energija - začetna energija> 0
Zato je končna energija večja od začetka.
Proizvodnja
Endotermalne reakcije zahtevajo, da se delajo na sistemu, zato običajno niso spontane.
Vendar pa obstaja nekaj endotermičnih reakcij, kot sta taljenje ledu in izhlapevanje nekaterih tekočin, ki so spontane pri sobni temperaturi.
Nato se sklepa, da je temperatura okolja odločilni dejavnik v spontanosti kemijske reakcije.
Lahko vam služi: kemični kazalniki: za kaj so, vrste, primeriPrimeri
Številne reakcije, ki vključujejo raztapljanje soli in na splošno razgradnja snovi, so običajno endotermične. Na enak način so prehod ledu v tekočo vodo in parna tekoča voda, torej transformacije stanja, tudi endotermične reakcije.
1. Fotosinteza
Rastline izvajajo kemično reakcijo v prisotnosti sončne svetlobe, v kateri pretvorijo ogljikov dioksid in vodo v glukozo in kisik. Klorofil je ključna molekula v tem procesu, katere kemična reakcija je:
Svetloba + 6Co2 + H2O → c6H12Tudi6 + 62
Kot je razvidno, je to obratna reakcija dihanja. Za izdelavo kilograma glukoze je potrebnih 15 mega joulov sončne energije.
2. Zavremo vodo in kuhamo
Zelo pogosta reakcija, ki zahteva energijo za nadaljevanje, je vrela voda:
H2O (tekočina) + energija → h2O (para)
Hrana običajno potrebuje vodo za kuhanje, na enak način pa mora voda, ki jo vsebujejo, izhlapi, da jih kuha, kar vključuje spremembo stanja.
3. Taliti led
Podobno je običajno, da se led topi pri sobni temperaturi, če je to večje od 0 ° C:
H2O (trdna) + energija → h2O (tekočina)
Zato se pijača ob dodajanju ledu ohladi, saj absorbira energijo, potrebno za spremembo stanja iz tekočine.
4. Hladne torbe
Uporabljajo se za zdravljenje modric in udarcev. Vsebujejo vodo in ovojnico z amonijevim kloridom. Ko tapnete vrečko, se ovojnica zlomi in reakcija amonijevega klorida z vodo, ki je endotermična, ohladi vrečko in lajša bolečino.
5. Proizvodnja ozona
Ultravijolično sevanje od sonca pretvori kisik v ozon, sprošča toploto v postopku.
3. mesto2 (plin) + ultravijolična svetloba → 23 (plin)
Reference
- ByJU's. Razlika med edotermičnimi in eksotermičnimi reakcijami. Okreval od Byjusa.com
- Chang, R. (2013). Kemija. 11VA. Izdaja. McGraw Hill Education.
- Grelan. Eksotermične reakcije na ogrevanje stvari. Okreval od: Grelane.com.
- Hein, m. (2014). Temelji kemije na fakulteti. Wiley.
- Čelada, a. Razumevanje endotermičnih in eksotermičnih reakcij. Okreval od: Thoughtco.com

