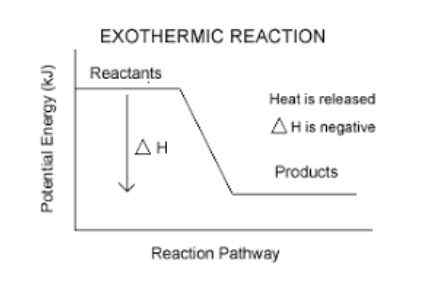
Eksotermična reakcija
- 1181
- 342
- Raymond Moen
Pojasnjujemo, kaj so eksotermične reakcije, njihove značilnosti, razlike z endotermičnimi reakcijami in dajejo več primerov
Kaj so eksotermične reakcije?
The eksotermične reakcije So kemične reakcije, ki sproščajo energijo v obliki toplote. Eksotermična beseda tvori "Exo" kar pomeni "ven" in "Thermos" kar pomeni toploto, zato "eksotermična reakcija" dobesedno pomeni reakcijo, v kateri toplota ugasne.
Te reakcije so zelo pogoste in jih lahko najdemo povsod, od domov do celic, ki so del našega telesa.
Doma jih lahko najdemo v kuhinji, ko plin gori v rogu, da skuhamo našo hrano. Najdemo jih tudi v avtomobilskih motorjih, ko kurijo gorivo.
 Primer eksotermične reakcije
Primer eksotermične reakcije Po drugi strani so eksotermične reakcije bistvene za življenje, saj celice zagotavljajo energijo, ki jo potrebujejo za življenje, rast in razmnoževanje.
Značilnosti eksotermičnih reakcij
Sprostijo energijo v obliki toplote
To je glavna značilnost, zaradi katere so eksotermične reakcije.
Izpuščena energija prihaja iz istih reagentov
Vsaka kemična reakcija zahteva nekaj aktivacijske energije. V primeru eksotermičnih reakcij ta energija izvira iz istih reagentov, ko se pretvori v izdelke.
Eksotermične reakcije so izdelki vedno bolj stabilni kot reagenti.
Reagenti s postati izdelki izgubijo del svoje energije v obliki toplote. Zaradi tega izdelki vedno ostanejo z manj energije kot reagenti, zaradi česar so bolj stabilni.
Imajo negativno spreminjanje entalpije.
To je preprost način za vedeti, ali je reakcija eksotermična ali ne. Vsaka reakcija, ki ima negativno AH (beri delta h), bo eksotermična.
- Na primer, Reakcija zgorevanja butana (plin, ki ga kurimo v kuhinji) ima entalpijsko variacijo -11.823 kcal/mol. Zato gre za eksotermično reakcijo.
V večini primerov potrebujejo samo sprožilec.
Številne eksotermične reakcije potrebujejo le nekaj, kar jim daje dovolj energije za začetek. Po tem je enaka toplota, ki jo sproščajo.
- Na primer, Z kurjenjem plina je potrebna samo ena iskra, potem se plamen še naprej vklopi, dokler se plin ne konča.
Razlike med eksotermičnimi reakcijami in endotermičnimi reakcijami
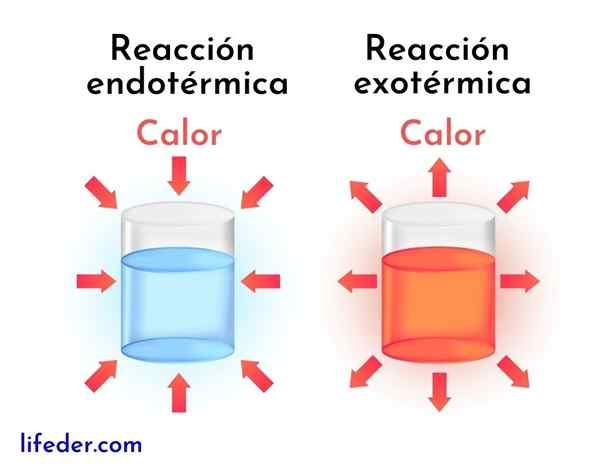
Eksotermične reakcije so nasprotje endotermičnih reakcij. V slednjem reagenti absorbirajo energijo v obliki toplote, namesto da bi jo sprostili, kot v eksotermičnih reakcijah.
Nato so predstavljene glavne razlike med eksotermičnimi in endotermičnimi reakcijami:
Eksotermične reakcije | Endotermične reakcije |
Sprostijo energijo v obliki toplote. | Absorbirajo energijo v obliki toplote. |
Imajo negativno spreminjanje entalpije, to je DH<0. | Imajo pozitivno spreminjanje entalpije, to je dh> 0. |
Ponavadi povečujejo okoliško temperaturo. | Ponavadi znižajo temperaturo ali se ohladijo. |
Energija, ki ohranja reakcijo, prihaja iz istih reagentov. | Energija, ki ohranja reakcijo, prihaja iz okolice. |
Z manj energije se vedno pridobijo bolj stabilni izdelki. | Manj stabilni izdelki se vedno pridobijo z višjo raven energije. |
Primeri eksotermičnih reakcij
Izgorevanje kuhinjskega plina
V večini domov na svetu je plin, ki se uporablja za kuhanje hrane, butana, ki ima molekularno formulo C4H10. Ta ogljikovodik je zgorel s kisikom zraka z naslednjo reakcijo zgorevanja, ki sprošča velike količine toplote:
Vam lahko služi: preprost mikroskop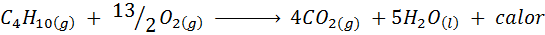
Eksplozija dinamita
Dynamit vsebuje eksploziv, imenovan nitroglicerin (c3H5N3Tudi9). Ta spojina razpade zelo silovito sprošča velike količine toplote, kar povzroča veliko eksplozijo. Kemična reakcija je:
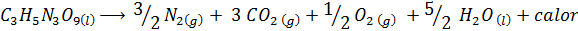
Ta reakcija ima a ΔH = -368 kcal⁄mol, Torej gre za eksotermično reakcijo.
Spontano zgorevanje belega fosforja
Element fosforja (P) najdemo kot rdeč fosfor ali beli fosfor. Beli fosfor. Reakcija je:
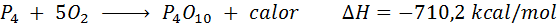
Celično dihanje
Celično dihanje je eksotermična kemična reakcija, ki je sestavljena iz oksidacije hrane, ki jo jemo. Toploto, ki jo sprošča ta reakcija, celice uporabljajo za izvajanje neskončnih endotermičnih kemičnih reakcij, ki potrebujejo energijo.
Ognjemet
Ognjemet vsebuje črnega smodnika kot glavne eksplozivne komponente. Gudnik je mešanica, ki vsebuje kalijev nitrat, grafit in žveplovo ogljik, ki med seboj reagirajo skozi eksotermično reakcijo. Vročina, ki jo sprošča ta reakcija, ustvarja široko paleto barv, ki jih vidimo v nebesih, ko ognjemet eksplodira.
Kemična toplotna blazinica
Toplotne blazinice se uporabljajo kot vroče stiske za lajšanje športnih poškodb. Te so sestavljene iz zaprte vrečke, ki vsebuje vodo, in kemiko v majhni cevi. Ko se cev razbije, se kemik pomeša z vodo, ki proizvaja eksotermično kemično reakcijo, ki segreva blazinico.
Kovinska reakcija natrija z vodo
Natrij (NA) je zelo reaktivna alkalna kovina, ki ob stiku z vodo reagira nasilno sproščanje veliko toplote in plinastega vodika. Reakcija je:
Lahko vam služi: metode ločevanja heterogenih mešanic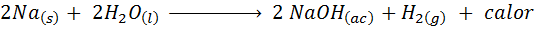
Ta reakcija sprosti 1900 kalorij za vsak gram NA, ki reagira z vodo. To pomeni, da bi bil 1 gram natrija dovolj za ogrevanje 3 srednje kavne skodelice.
Raztapljanje detergenta
To je reakcija, ki jo lahko vsak doživi v svojem domu. Ko vzamete peščico prašnega detergenta za umivanje oblačil in ga navlažite z malo vode, se bo roka takoj počutila vroče. To je zato, ker je postopek raztapljanja detergenta v vodi eksotermičen.
Trimita reakcija
Termita je mešanica aluminija v obliki zelo finega prahu in oksida druge kovine, kot je železo. Po iskri je reakcija, ki se pojavi:
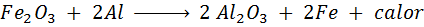
Ta reakcija sprošča toliko toplote, ki je sposobna tapati železo in se veliko uporablja za varjenje tirnic.
Kondenzacija vode
Za vse snovi spremembe plinske faze (kondenzacija), tekočina v trdno (strjevanje) in trden plin (odlaganje) vedno sproščajo toploto in so zato eksotermični procesi. V primeru vode se kondenzacija samo 18 gramov vode sprosti približno 10.000 kalorij, kar je dovolj za ogrevanje 15 majhnih skodelic za kavo.
Reference
- Chang, R. in Goldsby, k. (2014). Kemija. 11. izd. New York: McGraw-Hill Education.
- Eksotermična reakcija (2020, 19. decembra). V Wikipediji. Odvzet od.Wikipedija.org
- Holmes, w. S. (1963). Toplota zgorevanja fosforja in entalpije tvorbe P4O10 in H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada str. od., F. Yo. (2014). Petarde, rakete in veliko kemije. Kemična izobrazba. 44-51. Doi: 10.2436/20.2003.02.134
- Termitna reakcija. Univerza v Minnesoti (Oddelek za kemijo). Vzeti iz kem.Umn.Edu

