Vrste reakcij sinteze, dejavniki, primeri
- 4515
- 1301
- Stuart Armstrong
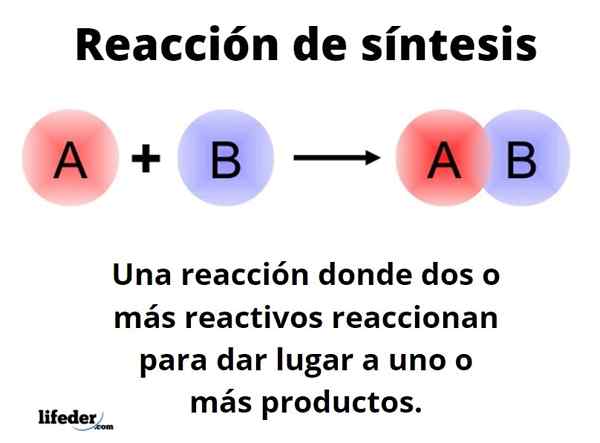
The Reakcija sinteze To je tisto, v katerem dva ali več reagentov reagirata, da lahko količinsko izvirata, enega ali več izdelkov, bodisi na laboratorijski ali industrijski ravni. To je ena izmed najbolj temeljnih reakcij kemije in njenih vrst in oblikovanja meje skoraj neskončnost.
Splošen način je mogoče predstaviti z obliko: A+B → C. V preprosti reakciji sinteze reagent na reagira z drugim reagentom B, da nastane C produkt. Govori se, da je sestavljen iz enega samega koraka. Vendar se lahko zgodi, da najprej reagiramo z E, sledi F in končno z G (drugim reagenti), da se spremeni v izdelek C; to pomeni, da enaka reakcija poteka v več korakih.

Ne glede na en korak ali veliko, vse reakcije sinteze temeljijo na učinkovitosti (termodinamika in kinetike), s katero reagenti reagirajo na preoblikovanje v produkte, kot tudi na eksperimentalne zmogljivosti. Zaželeno je, da reakcija sinteze uspešno prehaja in proizvaja čim več izdelkov.
[TOC]
Vrste reakcij sinteze
Preprost ali več
Reakcije sinteze ni povsem enostavno razvrstiti. To je lahko vprašanje, povezano z merili kemika. Ker? Recimo, da je zgoraj komentirana večkratna reakcija:
A + E → P1
Str1 + F → p2
Str2 + G → c
Biti p1 In p2 posredniki, ki niso zanimivi. Reakcija sinteze ali spojine C, ki se začne od glavnega reagenta A (omejevanje ali omejevanje reagenta), je večkratna ali zapletena, ker se pojavlja v več korakih, v katerih sodelujejo drugi reagenti: E, F in G.
Vsaka od prejšnjih treh reakcij je lahko sestavljena in vrsta kemijske reakcije sama po sebi. To pomeni, da je reakcija sinteze lahko katere koli druge vrste kemijskih reakcij (dvojni premik, redoks, zgorevanje, nevtralizacija, nitriranje, substitucija itd.), dokler izdelek izvira in ima povezano eksperimentalno zmogljivost.
Tako:
A + E → P1
Lahko ga vidimo kot preprosto reakcijo sinteze za produkt P1, Ne glede na vrsto reakcije. In tudi:
Str1 + F → p2
To je še ena preprosta reakcija sinteze za produkt P2.
Anorganski ali organski
Reakcije sinteze so lahko kakršne koli vrste glede narave reakcije in njegovega molekularnega mehanizma. Vendar jih lahko razdelimo glede na kemično naravo reagentov in izdelkov.
Vam lahko služi: natrijev acetat: struktura, lastnosti, sinteza, uporabaNa primer, če so reagenti anorganske snovi, potem govorimo o anorganski sintezi; Medtem ko bi bile organske snovi, bi že govorili o organski sintezi.
Polje organske sinteze je kolosalno, saj zajema produkcije zdravil, barvil, plastike, insekticidov, lepil, parfumov, konzervansov med tisoči drugih izdelkov.
Dejavniki, vključeni v reakcije sinteze
Dejavniki, ki sodelujejo pri sinteznih reakcijah, so vsi ti parametri ali spremenljivki, fizikalni in kemični. Nekateri od njih so naslednje:
Temperatura
Temperatura je bistvena pri vsaki reakciji sinteze. Glede na vašo termodinamiko je morda priročno, da ostane nizka ali visoka. Prav tako obstajajo temperature, kjer so nezaželene stranske reakcije verjetne, zato je bistvenega pomena za nadzor in preverjanje.
Čas
Čas je bistvenega pomena tudi pri sinteznih reakcijah, saj mora zagotoviti, da je dovolj, da zagotovi vzpostavitev ravnotežja. Po določenem času bo več izdelkov prenehalo pridobiti, in takrat se odloči, da bo sintezo popolnoma ustavil.
Koncentracije in kakovost reagentov
Bolj ko so koncentrirani reagenti, hitreje bodo reakcije. Ključnega pomena je tudi, da je jasno, da je delež njegovih koncentracij in njenih velikosti, saj bo minimalna sprememba vplivala na končno zmogljivost.
Po drugi strani morajo biti reagenti čim bolj čiste, sicer bodo predvidene napačne koncentracije; Ali še huje, izdelki bodo kontaminirani ali pa se bodo pojavile nezaželene reakcije.
Vznemirjenje
Način mešanja reakcijskega medija bo vplival na rapide reakcij sinteze.
Pritisk
Tlak, podobno kot koncentracija, ima ključno vlogo, zlasti kadar so reagenti vrste ali snovi sode. Večji kot je pritisk, večji so trki ali interakcije med reagenti in zato bo večja verjetnost, da se bodo reagirali.
ph
PH (kislina ali osnovna) neposredno vpliva na mehanizem reakcije, zato je ključni dejavnik pri določanju, kateri izdelki bodo pridobljeni na koncu sinteze.
Vam lahko služi: vrelišče: koncept, izračun in primeriKatalizatorji
Katalizatorji so snovi, ki pospešujejo kemične reakcije, vendar brez porabe med postopkom. Obstaja sinteza, da bi brez vašega posredovanja to nemogoče.
Primeri reakcij sinteze
Naslednje in končno bodo navajale kemijske enačbe za sintezne reakcije več spojin.
Namizna sol (natrijev klorid)
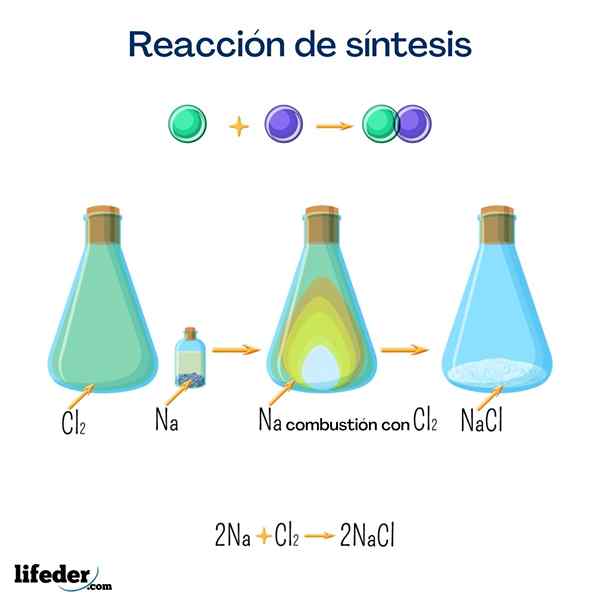
Ta sol je ena najbolj znanih po svoji veliki domači uporabi. Dobimo ga iz natrija in klora, in čeprav ga lahko dobimo z naslednjo reakcijo.
2 Na+Cl 2 → 2 NaClGlukoza
To je ena najpomembnejših reakcij za življenje, kot ga poznamo. Rastline uporabljajo ogljikov dioksid in okolje s sončno svetlobo za proizvodnjo glukoze in kisika.
Reakcija na zelo splošen način si lahko ogledate spodaj, vendar je pomembno razumeti, da za njo obstaja več reakcij in mehanizmov, da bi bili to možni.
6CO2 + 6H2O → C6H12O6 + O2
Saharoza
Ta sintezna reakcija se pojavi v živih organizmih in se daje pri polimeriziranju glukoze s fruktozo. Zaradi svoje strukture medsebojno delujeta dva molekula, končni rezultat pa je saharoza in voda, kot je razvidno iz naslednje enačbe:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Amoniak
3 h2(g) + n2(g) → 2 NH3(g)
Reagenti h2 in n2 So plinasti. Tlak mora biti visok, da vaše molekule reagirajo in izvirajo v amoniaku, NH3. To je ena najpomembnejših sinteznih reakcij industrijske kemije.
Voda
2 h2(g) + oz2(g) → 2 h2O (g)
H2 jaz2 reagirajo eksotermično, da proizvajajo vodno paro. Količina sproščene energije je takšna, da je vodik eno najbolj obetavnih goriv v vesoljskih aplikacijah.
Alkohol
C2H4(g) + h2Ali (l) → cho3Pogl2OH (L)
Etanol je znan kot alkohol, le eden izmed mnogih alkoholov, ki obstajajo. Njegova sintezna reakcija je sestavljena iz hidracije etilena, c2H4 ali h2C = pogl2, kjer se v dvojno vez doda molekula vode.
Žveplova kislina
Žveplova kislina ima več učinkovitih sintetičnih poti. Vendar je najpreprostejši sestavljen iz več korakov:
Vam lahko postreže: karboksimetilcelulozaS (s) +o2(g) → Torej2(g)
2 Torej2(g)+oz2(g) ⇌ 2 Torej3(g)
SW3(g)+h2Ali (l) → h2SW4(g)
H2SW4(g) → h2SW4(L)
Žveplo gori z odvečnim kisikom, da se najprej spremeni v SO2, In potem v tako3. Potem SO3 je hidriran za proizvodnjo H hlapov2SW4, ki končno kondenzira v h2SW4 tekočina. Ta sinteza je tako pomembna, da sama po sebi kaže, kako močna.
Metanol
Co (g) + 2 h2(g) → ch3OH (L)
Plini co in h2 reagirati in kondenzirati na kovinskih katalizatorjih, da povzroči metanol, najpreprostejši alkohol od vseh.
Magnezijev sulfat
Pojavi se lahko iz zelo preproste reakcije, ki je sestavljena iz magnezija in žveplove kisline. V naravi ga je zelo težko najti brez vode.
Mg + H2SO4 → H2 + MGSO4
Ogljikov dioksid
Zgodi se naravno v več procesih, ko nastane ogljikov dioksid z molekulo ogljikovega dioksida.
Prisoten je v naravnih procesih, kot je dihanje, kot reagent v fotosintezi in se zlahka pojavi v reakcijah zgorevanja.
C +O2 → CO2
Klorovodikova kislina
Klorovodikova kislina se pogosto uporablja kot poceni kislina in kot reaktivno sredstvo za sintezo drugih spojin.
Cl2+H2 → 2HCl
Kalcijev karbonat
V naravi je splošno znan kot zelo obilen sredstvo, predvsem v skalah, mineralih in školjkah v morju. Njegova reakcija temelji na interakciji kalcijevega oksida z ogljikovim dioksidom.
CAO +CO2 → CACO3
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Metler Toledo. (s.F.). Reakcije sinteze. Okrevano od: mt.com
- Čelada, Anne Marie, ph.D. (27. avgust 2020). Opis reakcije sinteze plus izpiti. Pridobljeno iz Thoughtco.com
- Wikipedija. (2020). Kemična sinteza. Pridobljeno iz: v.Wikipedija.org
- Danielle Reid. (2020). Reakcija sinteze: definicija, formula in primer. Študij. Okrevano od: študij.com

