Radikali izposojajo, kako se oblikujejo, nomenklatura, primeri

- 3602
- 411
- Lee Farrell
The RADILS RANT So niz nestabilnih molekul, ki izvirajo iz izgube vodikov alkana. Za njih je značilno, da imajo izginot elektron, zato hitro reagirajo, da dokončajo okto Atoma, kjer se nahaja.
Ti radikali so simbolizirani s črko R, prav tako tudi skupine za najem, vendar z razliko, da je dodana točka, r ·. Ta točka kaže, da je prisotnost elektrona izginila. Na primer razmislite o metanskem plin, cho4. Ta alkana, ki bo izgubila enega od njenih vodikov, se bo spremenila v radikalni metil, Cho3· (Slika spodaj).
 Splošna formula radikalnega alkila in radikalnega metila. Vir: Gabriel Bolívar prek Molview.
Splošna formula radikalnega alkila in radikalnega metila. Vir: Gabriel Bolívar prek Molview. Če želite malo poglobiti o radikalni strukturi ch3· Videti bo, da je njen izginil elektron pod kotom, pravokotno na povezave C-H; to pomeni, da se nahaja v orbitalu str Čisto. Zato Cho3· Sprejeti hibridizacijo SP2, pa tudi na splošno z drugimi radikali alkil.
Ti radikali so temelj verižnih reakcij, kjer sodelujejo alkani, kot je primer njihovih halogenacij: kloriranje, bromacija itd. Obstajajo 1., 2. in 3. radikali, pa tudi vinil in alilični, vsak s svojo stabilnostjo in enostavnostjo treninga.
[TOC]
Kako nastajajo radikali alkil?
"Enostavnejša" reakcija, za katero nastanejo radikali, je halogenacija alkanov. Za oblikovanje je treba dati verižno reakcijo, ki se pojavi le pri visokih temperaturah (presega 250 ° C) ali pod pojavom ultravijolične svetlobe pri sobni temperaturi.
Vam lahko služi: natrijev sulfit (NA2SO3)Razmislite o kloriranju metana pod enim od zgoraj omenjenih pogojev:
Cl2 → 2Cl ·
Zadevana energija je dovolj za razbijanje CL-CL povezave molekule klora, ki se pojavi homolitični prelom; to pomeni, da vsak atom klora ostane z enim od povezanih elektronov. Zato nastaneta dva radikala.
Nato radikalni cl · napade molekulo metana:
Cl · + ch4 → HCl + Ch3·
In pojavi se radikalni metil. Ta pogl3· Precej nestabilen je, zato bo takoj reagiral, da bo osvojil dodatni elektron, s katerim se bo pojavil njegov osamljen elektron:
Pogl3· + Cl2 → pogl3Cl + cl ·
Oblikovana bo reagirana z drugo molekulo metana in cikel se bo ponovil vedno znova. Ko zmanjka metana, bodo prišle naslednje reakcije, ki bodo končale verižno reakcijo:
Cl · + · cl → cl2
Pogl3· + · Cho3 → pogl3Pogl3
Pogl3· + · Cl → ch3Cl
Relativna stabilnost
Pogl3
Metan ni edini alkan, ki ga "radikalizira" s kloriranjem. Enako se zgodi tudi z etanom, propanom, butanom in drugimi izomeri. Vendar se razlikuje potrebna energija, ki jo je treba zagotoviti tako, da radikali cl · dehidrogirajo molekulo alkana. V primeru metil radikala je zelo nestabilen in zato težko oblikovati.
Tako radikalni cho3Pogl2· Je bolj stabilen in enostaven za oblikovanje kot CHO3·. Ker? Ker radikalni ch3Pogl2· To je primarno, 1., kar pomeni, da je izginil elektron na ogljikovem atomu, ki je povezan z drugim ogljikom. Medtem, Cho3Takoj, ko je povezan z vodikovimi atomi.
Lahko vam služi: fluorid: zgodovina, lastnosti, struktura, pridobivanje, tveganje, uporabeZa kaj je to? Če se spomnimo prejšnjega reprezentacije, je izginil elektron v orbitalu str, pravokotno na druge povezave. V pogl3· Atomi vodikov komaj dajejo elektronsko gostoto ogljikovemu atomu, da bi nadomestili pomanjkanje drugega elektrona.
1
V pogl3Pogl2· Po drugi strani je ogljik z izginotnim elektronom povezan z dvema vodikoma in metilno skupino. Posledično ta ogljik prejme večjo elektronsko gostoto, ki pomaga stabilizirati elektron, ki je nekoliko izginila. Enaka razlaga velja za druge radikale 1. alkinda.
2. mesto
V radikalnem sekundarnem ali 2. alquilu, kot je izopropil radikal (CH3)2C. Zato je bolj stabilen kot prvi in metilni radikali.
3. mesto
Imamo tudi terciarne ali 3. alkindne radikale, kot je ter-butilni radikal3)3C ·. Ti so bolj stabilni od 1. in 2. Zdaj obstajajo tri gazirane skupine, ki se razlikujejo od vodikovega atoma, ki stabilizirajo izginot.
Alilski in vinil
Omeniti je treba tudi alililne radikale, Cho2= Ch-ch2·, In vinil, cho2= Ch ·.
Alilic je najbolj stabilna od vseh. To je zato, ker se izginotni elektron lahko celo premika na ogljikov atom drugega konca. Vínilico je na drugi strani najbolj nestabilen od vsega, saj skupina CHO2=, več kisline, pritegne elektronsko gostoto do sebe, namesto da bi jo daroval proti ogljiku z elektronom, izginil.
Vam lahko služi: svinčeno hidroksid: struktura, lastnosti, uporabe, tveganjaČe povzamemo, je relativna stabilnost radikalov alkind, od najvišjih do najnižjih,:
Alilo> 3.> 2.> 1.st> vinil
Nomenklatura
Nomenklatura radikalov alkil je enaka za zdravilo. Tako, cho3Pogl2· Imenuje se etilni radikal; in radikalni ch3Pogl2Pogl2Pogl3, n-batil.
Najem glavnih radikalov
Glavni alkilni radikali sovpadajo z alkilnimi skupinami: to so tisti, ki imajo manj kot šest ogljikovih atomov. Zato so radikali izpeljani iz metana, etana, propana, butana in pentana, najpogostejši. Prav tako sta radikalna vinil in Alilicos del tega seznama.
Drugi alkind radikali, ki jih najdemo manj pogosto, so tisti, ki izhajajo iz cikloalkanov, kot so ciklobutan, ciklobutan ali ciklopentano.
Na naslednji sliki je več teh radikalov predstavljenih z dodeljenimi črkami:
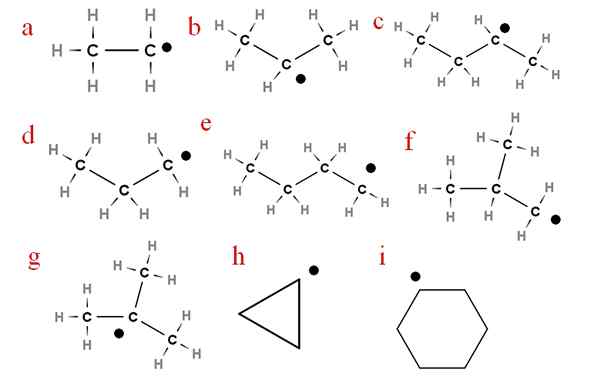 Devet najpomembnejših alchery radikalov. Vir: Gabriel Bolívar.
Devet najpomembnejših alchery radikalov. Vir: Gabriel Bolívar. Začenši s črko 'a', imamo:
-a, etilni radikal
-B, izopropilni radikal
-C, secbutil radikal
-D, radikalni propil
-E, radikalen n-batil
-F, izobutil radikal
-G, ter-butil radikal
-H, radikalni cikropil
-I, radikalni cikloheksil
Vsak od teh radikalov lahko ali ne bo imel svojih vodikov, ki jih nadomestijo druge skupine, zato so enako raznoliki kot alkani in njihovi strukturni izomeri.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Alkil. Pridobljeno iz: v.Wikipedija.org
- Kemija librettexts. (5. junij 2019). Struktura alkilnih radikalov: hiperkonjugacija. Okrevano od: kem.Librettexts.org
- « Koncept, funkcije, primeri navzkrižnih referenc
- Karakteristike vodnih živali, dihanje, vrste, primeri »

