Kaj sta anoda in katoda?

- 4996
- 1276
- Raymond Moen
On anoda in katoda So vrste elektrod, ki jih najdemo v elektrokemičnih celicah. To so naprave, ki lahko proizvajajo električno energijo s kemično reakcijo. Najbolj uporabljene elektrokemične celice so baterije.
Obstajata dve vrsti elektrokemičnih celic, elektrolitskih celic in galvanskih ali voltaičnih celic. V elektrolitskih celicah se kemična reakcija, ki jo proizvaja energija.

Galvanska celica je sestavljena iz dveh pol -LODG -jev. Ti so povezani z dvema elementoma, kovinskim voznikom in slano mostom.
Električni prevodnik, kot je navedeno z njegovim imenom, vodi elektriko, ker ima zelo malo odpornosti proti gibanju električnega naboja. Najboljši vozniki so običajno kovine.
Salinski most je cev, ki povezuje obe pol -litalnici, hkrati pa ohranja svoj električni stik in ne da bi se komponente vsake celice pridružili.Vsak pol -media galvanske celice vsebuje elektrodo in elektrolit.
Ko pride do kemijske reakcije, ena od pol -oltov izgubi elektrone na njegovo elektrodo s postopkom oksidacije; Medtem ko drugi zmagajo na elektroni za elektrodo, s postopkom redukcije.
Procesi oksidacije nastajajo v anodi in procesi redukcije v katodi
[TOC]
Anoda
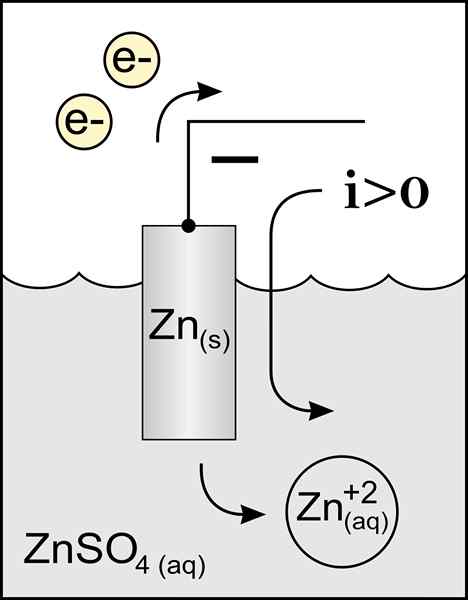 Diagram cinkove anode v voltaični celici. Vir: Originalno delo: Datoteka: cink Anoda 2.PNG UPORABNIK: Micheljullian (Talk) Derivacijsko delo: KES47/CC BY-S (http: // CreativeCommons.Org/licence/by-sa/3.0/)
Diagram cinkove anode v voltaični celici. Vir: Originalno delo: Datoteka: cink Anoda 2.PNG UPORABNIK: Micheljullian (Talk) Derivacijsko delo: KES47/CC BY-S (http: // CreativeCommons.Org/licence/by-sa/3.0/) Ime anode izvira iz grške ανά (Aná): up in οδός (Odos): pot. Faraday je bil tisti, ki je ta izraz skoval v devetnajstem stoletju.
Najbolje definirajoča anoda je elektroda, ki izgubi elektrone v reakciji oksidacije. Običajno je povezan s pozitivnim polom tranzita električnega toka, vendar ni vedno tako.
Vam lahko služi: cenjene rešitveČeprav je v baterijah anoda pozitiven pol, je v LED lučh nasprotno, anoda pa je negativna pol.
Običajno je občutek električnega toka opredeljen, saj ga ceni kot občutek prostih obremenitev, če pa voznik ni kovinski, se pozitivni naboji, ki se proizvedejo, prenesejo na zunanji gonilnik.
To gibanje pomeni, da imamo pozitivne in negativne naboje, ki se premikajo v nasprotnih čutilih, zato se reče, da je smer toka pot pozitivnih nabojev kationov, ki so v anodi proti negativni obremenitvi anod anode, ki jih najdemo v katodi.
V galvanskih celicah, ki ima kovinski prevodnik, tok, ustvarjen v reakciji, sledi poti od pozitivnega pola do negativnega.
Toda v elektrolitskih celicah, ki nimajo kovinskega prevodnika, ampak elektrolit, ioni s pozitivno in negativno obremenitvijo, ki se premikajo v nasprotnih čutilih.
Termoionske anode prejmejo večino elektronov, ki prihajajo iz katode, segrejejo anodo in morajo najti način za razpršitev. Ta toplota nastane v napetosti, ki se pojavlja med elektroni.
Posebne anode
Obstaja vrsta posebnih anod, na primer tiste v x -roys. V teh cevh energija, ki jo proizvajajo elektroni, poleg proizvodnje x -trays ustvarja veliko energijo, ki segreva anodo.
Ta toplota se pojavi v različni napetosti med obema elektrodama in to izvaja pritisk na elektrone. Ko se elektroni premikajo v električnem toku, udarijo po anodo s prenosom toplote.
Vam lahko služi: Henderson-Haselbalch Enačba: Pojasnilo, primeri, vadbaKatoda
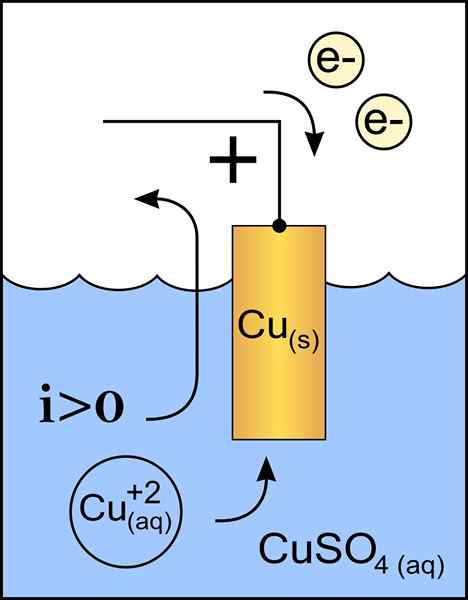 Diagram bakrene katode v voltaični celici. Vir: Originalno delo: Datoteka: cink Anoda 2.PNG UPORABNIK: Micheljullian (Talk) Derivacijsko delo: KES47/CC BY-S (http: // CreativeCommons.Org/licence/by-sa/3.0/)
Diagram bakrene katode v voltaični celici. Vir: Originalno delo: Datoteka: cink Anoda 2.PNG UPORABNIK: Micheljullian (Talk) Derivacijsko delo: KES47/CC BY-S (http: // CreativeCommons.Org/licence/by-sa/3.0/) Katoda je elektroda z negativno obremenitvijo, ki v kemični reakciji trpi redukcijsko reakcijo, kjer se njen status oksidacije zmanjša, ko sprejema elektrone.
Tako kot pri Anodi je tudi Faraday predlagal izraz katoda, ki prihaja iz grške κατά [Catá]: 'Down' in ὁδός [Odos]: 'Road'. Temu elektrodi smo sčasoma pripisali negativno obremenitev.
Ta pristop je bil napačen, saj ima odvisno od naprave, v kateri se nahaja, obremenitev.
Ta odnos z negativnim polom, tako kot pri anodi, izhaja iz domneve, da tok teče iz pozitivnega pola v negativno. To nastane znotraj galvanske celice.
Znotraj elektrolitskih celic lahko sredstva za prenos energije, saj ni v kovini, ampak v elektrolitu. Toda po dogovoru se reče, da tok preide od anode do katode.
Posebne katode
Vrsta specifičnih katod so termionske katode. V teh katoda oddaja elektrone zaradi učinka toplote.
V termionskih zaklopkih se lahko katoda segreje tako, da kroži ogrevalni tok v filamentu, ki ima povezan z njim.
Reakcija ravnotežja
Če vzamemo galvansko celico, ki je najpogostejša elektrokemična celica, lahko oblikujemo ravnotežno reakcijo, ki je nastala.
Vsak pol -media, ki tvori galvansko celico, ima značilno napetost, znano kot redukcijski potencial. Znotraj vsakega pol -media obstaja reakcija oksidacije med različnimi ioni.
Vam lahko služi: absorpcijski spekterKo ta reakcija doseže ravnotežje, celica ne more zagotoviti več napetosti. V tem času bo oksidacija, ki se odvija v pol -mediji tega trenutka, pozitivna vrednost, bližje je ravnotežje. Potencial reakcije bo večji, bolj kot je doseženo.
Ko je anoda v ravnovesju, začne izgubljati elektrone, ki gredo skozi voznika do katode.
V katodi poteka redukcijska reakcija, bolj potencialno ravnovesje bo imelo reakcijo pri proizvodnji in jemanju elektronov, ki prihajajo iz anode.
Reference
- Huheey, James in., et al.Anorganska kemija: načela strukture in reaktivnosti. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Kemija: načela in lastnosti. New York, ZDA: McGraw-Hill, 1966.
- Brady, James in.Splošna kemija: načela in struktura. Wiley, 1990.
- Petrucci, Ralph H., et al.Splošna kemija. Interameriški izobraževalni sklad, 1977.
- Masterton, William L.; Hurley, Cecile N.Kemija: načela in reakcije. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Elektrokemijske reakcije. Toray-Masson, 1969.

