Kaj je kemična periodičnost?
- 4020
- 371
- Percy Feeney
The Kemična periodičnost To je trend ali vzorec, ki prikazuje kemične elemente za niz njihovih kemičnih in fizikalnih lastnosti. To postane nekakšno sorodstvo, ki je bil temeljni vodnik za starše kemije, da organizirajo in razvrstijo vse elemente v današnji znani periodični tabeli.
118 obstoječih elementov (med naravnimi in umetnimi) v drugačni meri ohranjata razmerje med seboj, ki jih definira v družinah ali skupinah. Sprva je to omogočilo opis reaktivnosti elementov in vrsto spojin, ki se tvorijo; In še bolje, napovedujte lastnosti tistih, ki še niso odkrili.
 Elementi periodične tabele
Elementi periodične tabele Potem so bile te lastnosti, medtem ko sta dvajseto stoletje in fizika napredovala, povezana z elektronsko strukturo atoma. Tako elektroni označujejo kemijsko periodičnost v zvezi z elementi, vendar ne toliko za njihove izotope in relativno stabilnost.
Zahvaljujoč kemijski periodičnosti je mogoče razumeti, zakaj so elementi postavljeni v isto skupino v periodični tabeli. Omogoča tudi napovedovanje kemijskih lastnosti in celo fizične med elementi različnih atomskih mas.
[TOC]
Vzorci in skupine
 Tako kot cikcak vzorci teh oblakov tudi lastnosti elementov kažejo periodično in značilno težnjo. Vir: Pravin Bagga/CC by-S (https: // createCommons.Org/licence/by-sa/3.0
Tako kot cikcak vzorci teh oblakov tudi lastnosti elementov kažejo periodično in značilno težnjo. Vir: Pravin Bagga/CC by-S (https: // createCommons.Org/licence/by-sa/3.0 Kemična periodičnost opažamo, kot je pričakovano, v periodičnih lastnostih. Za njih je značilna težnja njihovih vrednot, saj se ocenjujejo v periodičnem obdobju ali skupini.
Za primerjavo lahko izberete cikcak, žago ali strmo goro: z vzponi in padci. To pomeni, da so občasne lastnosti, ki imajo minimalno in največ za določene elemente. In relativni položaji teh elementov, briljantno ustrezajo lokaciji v njihovih skupinah.
Zato je kemična periodičnost koristna za analizo na podlagi skupin; Vendar so obdobja bistvenega pomena za popolno vizijo trenda.
Vam lahko služi: kalijev karbonat (K2CO3): struktura, lastnosti, uporabe, pridobivanjeOpazili bomo z naslednjimi primeri periodičnosti v kemiji, ki ne dobijo le periodičnih lastnosti, ampak tudi v anorganskih spojinah in, vključno z organskimi.
Ionizacijska energija
Ionizacijska energija, je ena najbolj izjemnih periodičnih lastnosti. Večji kot je atom elementa, lažji bo eden od njegovih zadnjih elektronov odstraniti; Se pravi, tisti iz Valencije. Zato: atomi z majhnimi radijskimi napravami bodo imeli velike, atomi z velikimi radijskimi napravami pa bodo imeli majhne.
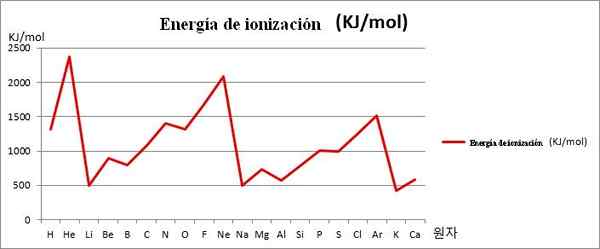 EI proti grafiki. Prvih 20 kemičnih elementov. Vir: Kenneth.JH.HAN/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0
EI proti grafiki. Prvih 20 kemičnih elementov. Vir: Kenneth.JH.HAN/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0 Opomba na primer na zgornji sliki, da imajo elementi li, Na in k mladoletnike EI, zato se nahajajo v dolinah ali sredstvih grafike. Medtem elemente, ki jih, ne in ar, najdemo na vrhu ali višje točke, saj so njihovi zelo veliki glede na druge elemente.
Elementi Li, Na in K spadajo v skupino alkalnih kovin, za katere so značilne njihove žrtve EI. Po drugi strani pa elementi, ki jih, ne in ar ustrezajo plemenitim plinom, z zelo visokimi, ker so njihovi atomi najmanjši med vsemi elementi za isto obdobje periodične tabele.
Tako kemična periodičnost kaže, da se zmanjša v skupino, vendar poveča gostovanje od leve proti desni.
Blok hidros str
Primer kemijske periodičnosti zunaj periodičnih lastnosti, ki jih vidimo v hidrorjih elementov blokov str.
Na primer, skupina 15 je sestavljena iz elementov n, p, as, sb in bi. Če je znano, da je amonijak, NH3, Ima dušik z oksidacijsko številko +3, potem je mogoče s preprostim periodičnostjo pričakovati, da imajo tudi preostali elementi podobne hidrose. In res je: NH3, Ph3, Pepel3, Sbh3 in BiH3.
Vam lahko služi: boron: zgodovina, lastnosti, struktura, uporabeDrug podoben primer se zgodi v skupini 16. Kisiški hidrid je h2Ali, voda. Ponovno se pričakuje, da imajo elementi S, SE, TE in PO hidrorke z enakimi formula. In to je: H2S, h2Se, h2Te in h2Po. To je posledica kemijske periodike.
Morda najbolj impresiven primer razumejo ogljikove, silicijeve in germanijeve hidros. Carbon hidrid je CHO4, In silicij, sih4. Germanio, ki ga je napovedal Mendeleev z imenom Eka-Silicio (ES), mora imeti kot periodičnost hidrid s formulo GEH4; napoved, ki je na koncu potrdila po njegovem odkritju in nadaljnjih študijah.
Halogenske molekule
Če je znano, da je fluorid v osnovnem stanju kot M molekula2, Potem se domneva, da tudi drugi halogeni (CL, BR, I in AT) tvorijo diatomske molekule. In to je, da so molekule CL2, Br2 in jaz2 Najbolj znan.
Oksidi in sulfidi
Podobno kot je omenjeno pri blok hidrorjih str, Oksidi in sulfidi za elemente iste skupine kažejo nekakšno dopisovanje v svojih kemičnih formulah. Na primer litijev oksid je li2Ali pa oksidi za druge alkalne kovine ali skupino 1: NA2V REDU2Ali RB2O in cs2Tudi.
To je zato, ker kovine z oksidacijsko številko +1 v interakciji z anionom oz2-. Enako se zgodi z njihovimi sulfidi: li2S, na2S itd. V primeru alkalinoternih kovin ali skupine 2 so formule njihovih oksidov in sulfidov: čebele in bes, mgO in MGS, Cao in CAS, SRO in SRS, BAO in BAS.
Lahko vam služi: selenarna kislina (H2SO3): Lastnosti, tveganja in uporabeTa periodičnost velja tudi za okside elementov blokov str: Co2, Sio2, Geo2, B2Tudi3, Do2Tudi3, Ga2Tudi3, itd. Vendar za blok elemente d ali druge bloka str, Ta periodičnost postane bolj zapletena zaradi najvišjih možnih številk oksidacije za isti element.
Na primer, baker in srebro pripadata skupini 11. Ena ima dva oksida: cuo (cu2+) in cu2Ali (cu+); Medtem ko ima drugi komaj samo enega: AG (AG+).
Ogljikovodiki in siloni
Tako ogljik kot silikon imata možnost oblikovanja vezi C-C oziroma Si-Si. C-C vezi so veliko bolj stabilne, zato lahko ogljikovodične strukture postanejo nesorazmerno številčnejše in raznolike od tistih njihovih siltanskih kolegov.
Ta zaključek je spet posledica kemijske periodičnosti. Na primer Ethane, Cho3Pogl3 ali c2H6 DiSilanum ima svoj kolega, SIH3Ja h3 ali če2H6.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Čelada, Anne Marie, ph.D. (26. avgust 2020). Opredelitev periodije v kemiji. Okreval od: Thoughtco.com
- In. V. Babaev, in Ray Hefferlin. (s.F.). Koncept kemijske periodičnosti:
Iz vzorcev hiper-periodičnosti Mendeleev molekularna miza. Okrevano od: kem.MSU.Ru - Rože str., Theopold k., & Langley r. (s.F.). Periodija. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Odprta univerza. (2020). Kemične vzorce najdemo v tabeli obdobja: Kemična periodičnost. Okrevano od: Open.Edu
- « Stabilen koncept in primeri ravnotežja
- Zgodovina podeželske sociologije, področje študija, pomen »

