Kaj je kemična kinetika?

- 2458
- 524
- Roman Schamberger
Pojasnjujemo, kaj je kemična kinetika, vrstni red in hitrost reakcije ter dejavnike, ki vplivajo na hitrost
Kaj je kemična kinetika?
The Kemična kinetika Podružnica kemije je odgovorna za preučevanje hitrosti kemijskih reakcij, kakšni dejavniki vplivajo na to hitrost in kakšne so posamezne mehanizme ali korake, skozi katere se pojavljajo kemične reakcije.
Poleg tega nam omogoča, da razumemo številne vidike kemijskih reakcij, kot sta kemična ravnovesje in aktivacijska energija, ter študije procesov katalize. Slednje je še posebej pomembno pri več aplikacijah, od biokemije do industrijskega inženirstva.
V središču kinetike je hitrost reakcije, ki jo je mogoče razumeti kot hitrost, s katero se reagenti preoblikujejo v izdelke. Vendar pa v kemični kinetiki obstaja veliko natančnejša definicija.
Opredelitev reakcijske hitrosti
Da damo popolno opredelitev reakcijske hitrosti, ki se uporablja v kemični kinetiki, začnimo z naslednjo generično kemijsko reakcijo:
V tej reakciji A in B predstavljata reagente, C in D predstavljata produkte, medtem ko A, b, c in d Predstavljajo ustrezne stehiometrične koeficiente.
Hitrost reakcije (predstavljena s simbolom v) Označuje, kako hitro. Matematično je to izraženo na naslednji način:
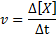
Kjer Δ [x] predstavlja spremembo molarne koncentracije vrst x (a, b, c ali d) v časovnem intervalu ΔT.
Očitno je, da hitreje zaužijemo kateri koli reagenti, hitreje bodo porabljeni drugi reagenti in hitreje se bodo pojavili izdelki. Zaradi tega je treba hitro določiti le v smislu enega od njih.
Lahko vam služi: metode ločevanja homogenih mešanicDa bi zagotovili, da je rezultat izračuna hitrosti vedno enak, ne glede na to, katere vrste je hitrost opredeljena, mora biti vedno razdeljen med stehiometrični koeficient in pred enačbo postaviti znak manj. To pomeni:
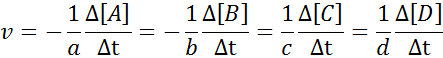
Primer definicije reakcijske hitrosti
Glede na naslednjo kemijsko reakcijo:
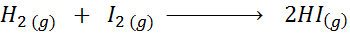
Napišite definicijo reakcijske hitrosti, odvisno od vsake vpletene vrste.
Rešitev:
V smislu h2:
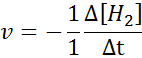
V smislu i2:
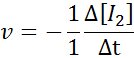
V smislu HI:
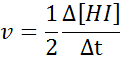
Zakon o hitrosti in reakcijski red
Reakcije se pojavijo, ko se atomi in molekule med seboj trkajo z zadostno energijo in pravilno orientacijo. Verjetnost, da se to zgodi, se poveča, saj so atomi in molekule bolj koncentrirani.
Zaradi tega je hitrost skoraj vedno odvisna od koncentracije reagentov. V nekaterih primerih je hitrost odvisna tudi od koncentracije katerega koli od izdelkov, pa tudi koncentracije katerega koli katalizatorja ali zaviralca, ki je prisoten v okolju.
Matematična enačba, ki povezuje hitrost reakcije na koncentracijo vpletenih vrst, se imenuje "Zakon o hitrosti"In v preprostejših primerih ima naslednji obrazec:
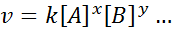
Kje k To je konstanta sorazmernosti hitrostna konstantna, in eksponenti A, B in katere koli druge vrste, ki se pojavljajo v enačbi, se imenujejo reakcijski naročili.
Glede na vsoto vseh reakcijskih naročil (ki se imenuje globalni red), lahko razlikujejo različne vrste reakcij. Te se razlikujejo od tega, koliko koncentracija vpliva na hitrost, v formuli časa, ki je potreben, da porabi polovico reagentov (polovico življenja) in na način, kako se koncentracija reagentov sčasoma spreminja (grafi [a] proti T ).
-
Reakcije naročila 0
Ko so vsi eksponenti v zakonu o hitrosti 0, se enačba zakona o hitrosti zmanjša na:
Vam lahko služi: usklajena kovalentna povezava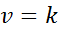
Z drugimi besedami, to so reakcije, ki se pojavljajo s konstantno hitrostjo in v katerih hitrost ni odvisna od koncentracije katerega koli reagenta ali izdelka.
Naročite grafe 0
Graf [a] v primerjavi z vrstnimi reakcijami 0 se spuščajo ravne črte.
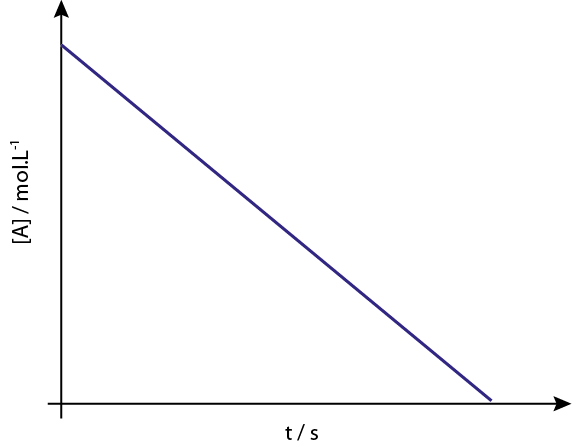
Legenda: Graf koncentracije v primerjavi z reakcijo reda 0 daje ravno črto.
Srednje življenje za red 0
Za reakcijo reda 0, čas pol življenja (t1/2) Daje:
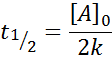
-
Reakcije 1. reda
V teh reakcijah se hitrost linearno spreminja s koncentracijo. Zakon o hitrosti prvega reda je:
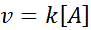
Grafika prvega reda
Graf [a] proti t reakcij prvega naročila se spuščajo hiperbole. Če pa je neperijski logaritem koncentracije (ln [a]) v primerjavi s časom, dobimo ravno črto.
 Graf koncentracije v primerjavi s časom reakcije reda 1 daje hiperbolo, vendar graf neperijskega logaritma koncentracije v primerjavi s časom daje črto
Graf koncentracije v primerjavi s časom reakcije reda 1 daje hiperbolo, vendar graf neperijskega logaritma koncentracije v primerjavi s časom daje črto Srednje življenje za reakcije prvega naročila
Za reakcijo reda 1, t1/2 Ni odvisno od začetne koncentracije in je podano z:
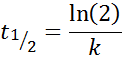
-
Reakcije drugega reda
Reakcija je lahko drugi vrstni red glede na en reagent ali prvi red glede na dva reagenta. V prvem primeru zakon o hitrosti daje:
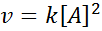
Grafika drugega reda
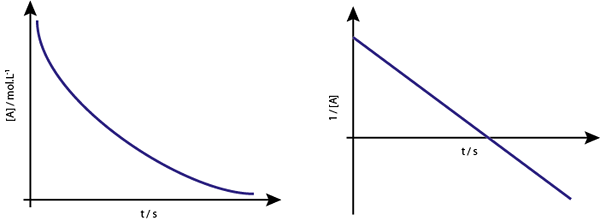
Graf [a] proti t reakcij drugega reda se spuščajo hiperbole. Če pa je narisana inverzna koncentracija (1/[a]) v primerjavi s časom, dobimo ravno črto.
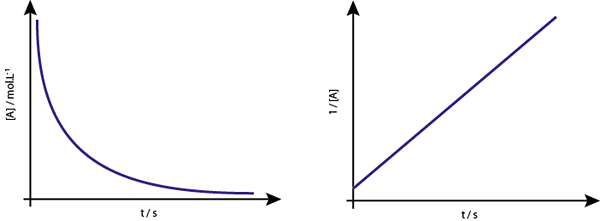 Graf koncentracije v primerjavi s časom reakcije vrstnega reda 2 daje krivuljo, podobno padajoči hiperboli, vendar graf koncentracije v primerjavi s časom daje črto
Graf koncentracije v primerjavi s časom reakcije vrstnega reda 2 daje krivuljo, podobno padajoči hiperboli, vendar graf koncentracije v primerjavi s časom daje črto Srednje življenje za reakcije drugega reda
Za reakcijo reda 2, t1/2 Daje:
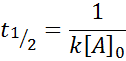
Dejavniki, ki vplivajo na reakcijsko hitrost
Temperatura
Temperatura vedno poveča hitrost, s katero se pojavljajo reakcije, saj se frekvenca in energija, s katero se molekule trčijo. Odvisnost od reakcijske hitrosti s temperaturo je podana z Arrhenijevo enačbo.
Lahko vam služi: magnezijev hidrid: struktura, lastnosti in uporabePritisk
Povečanje tlaka je enakovredno povečanju koncentracije vseh vrst v reakcijskem mediju (za reakcije plinske faze), zato povečanje tlaka poveča hitrost reakcij.
Katalizatorji
Katalizatorji so kemične snovi, ki se dodajo v medij samo zato, da povečajo hitrost reakcije. Večina katalizatorjev deluje s spreminjanjem reakcijskega mehanizma s tistim, ki zahteva nižjo aktivacijsko energijo.
Običajni primeri katalizatorja so encimi v živih sistemih in nekaterih kovinah, kot sta platina in paladij.
Zaviralci
Inhibitorji so nasprotje katalizatorjev. So snovi, ki reakcije naredijo počasneje. Antikorozivni so primeri zaviralcev, ki želijo zmanjšati hitrost korozijskih reakcij, da bi kovinske površine naredile več.


