Točka enakovrednosti

- 4339
- 753
- Adrian Legros
 Točka enakovrednosti je koncentracija stehiometrično dodane vrednosti, enaka količini analita
Točka enakovrednosti je koncentracija stehiometrično dodane vrednosti, enaka količini analita Kakšna je točka enakovrednosti?
On točka enakovrednosti Je ena, v kateri sta bili dve kemični snovi popolnoma reagirani. V reakcijah kisline baze to točko kaže, kdaj je celotna kislina ali baza nevtralizirana.
Ta koncept je vsak dan v volumetričnih stopinjah ali vrednotenju in ga določajo preprosti matematični izračuni.
V zvezi s tem je stopnja procesa, v katerem se v neznano koncentracijsko raztopino skrbno doda volumen znane koncentracijske raztopine, imenovan titula.
Uporaba indikatorja pH omogoča vedeti trenutek, ko se stopnja konča. Kazalnik je dodan v rešitev, ki je naslovljena na količinsko določitev koncentracije, ki jo želite vedeti.
Kazalnik kisline baze je kemična spojina, katere barva je odvisna od koncentracije vodika ali pH medija.
Sprememba barve indikatorja kaže na končno točko stopnje, čeprav ne točka enakovrednosti. V idealnem primeru se morata obe točki sovpadati, v resnici pa se lahko sprememba barve zgodi nekaj kapljic, potem ko je končana nevtralizacija ali baza kisline.
Kakšna je točka enakovrednosti?
Raztopina neznane koncentracijske kisline, nameščene v bučko.
Izbor indikatorja je treba izvesti tako, da spremeni barvo v mestu, da sta enaka količina kemičnih ekvivalentov titralne raztopine in neznana koncentracijska raztopina reagirala.
To je enakovredna točka, medtem ko točka, na kateri se kazalnik spremeni barvo.
Vam lahko služi: hipotonična rešitev: komponente, priprava, primeriKončna točka
Ionizacija ali disociacija indikatorja je predstavljena na naslednji način:
Hin +h₂o v- + H3Tudi+
In ima torej stalno ka
Ka = [h3Tudi+] [V-] / [Hin]
Razmerje med indikatorjem, ki ni dissociran (HIN), in disociiranim indikatorjem-) Določite barvo indikatorja.
Dodatek kisline poveča koncentracijo HIN in ustvari barvo 1 indikatorja. Medtem dodajanje baze daje prednost povečanju koncentracije disociiranega indikatorja-) (Barva 2).
Zaželeno je, da enakovredna točka sovpada s končno točko. Če želite to narediti, je izbran indikator z intervalom spremembe barve, ki vključuje točko enakovrednosti. Poleg tega gre za zmanjšanje kakršne koli napake, ki povzroči razliko med točko enakovrednosti in končno točko.
Standardizacija ali ocena rešitve je postopek, pri katerem se določi natančna koncentracija raztopine. To je metodološka stopnja, vendar je sledila strategija drugačna.
Raztopina primarnega standarda je nameščena v bučko in titularna raztopina, ki se standardizira, dodamo z bireto.
Enakovrednost titracije močne kisline z močno osnovo
100 ml 0,1 M HCl se namesti v bučko in postopoma dodamo z bireto, 0,1 M raztopino NaOH, pri čemer določa pH spremembe raztopine, ki povzroča klorovodikovo kislino.
Sprva je pred dodajanjem NaOH pH raztopine HCl 1.
Dodana je močna osnova (NaOH) in pH postopoma povečuje, vendar ostaja kisel pH, saj odvečna kislina to pH določa.
Vam lahko služi: kalijev jodid (ki): struktura, lastnosti, pridobivanje, uporabe, tveganjaČe NaOH nadaljuje, je čas, ko je dosežena enakovredna točka, kjer je pH nevtralen (pH = 7). Kislina je reagirala z uživanjem baze, vendar še ni presežka osnove.
Prevladuje koncentracija natrijevega klorida, ki je nevtralna sol (niti NA+ niti CL- so hidrolizirani).
Če NaOH nadaljuje, se pH še naprej povečuje in postaja bolj osnovni od točke enakovrednosti, ker koncentracija NaOH prevladuje.
V idealnem primeru bi se lahko spremenila barvna sprememba indikatorja pH = 7, vendar lahko zaradi nenadne oblike krivulje tima uporabimo fenolftalein, ki se v bledo roza barvo spremeni v pH okoli 8.
Jesenska šibka stopnja krivulja
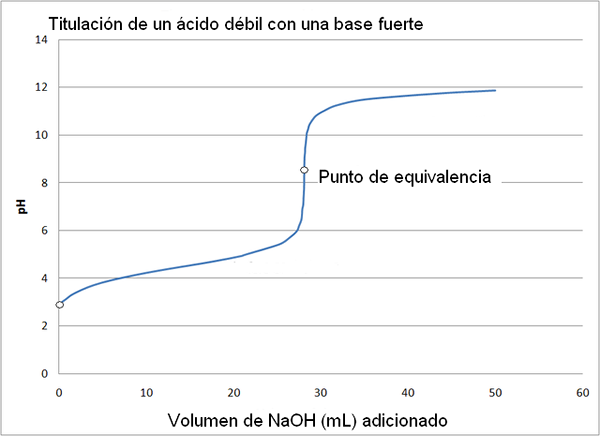 Šibka kislina in močna krivulja titracije. Vir: Wikimedia Commons
Šibka kislina in močna krivulja titracije. Vir: Wikimedia Commons Titracijska krivulja močne kisline z močno osnovo je podobna kot zgornja slika. Edina razlika med obema krivuljama je v tem, da ima prvi veliko bolj nenadno spremembo pH, medtem ko v titracijski krivulji šibke kisline z močno osnovo je razvidno, da je sprememba bolj postopna.
V tem primeru je naslovljena šibka kislina, na primer ocetna kislina (ch3COOH) z močno osnovo, natrijev hidroksid (NaOH). Reakcija, ki se pojavi v stopnji, lahko shematizira na naslednji način:
Naoh +ch3Cooh => ch3COO-Na+ + H₂o
V tem primeru je raztopina acetatnega pufra oblikovana s PKA = 4,74. Oblaženo območje lahko opazimo v rahli in skoraj neopazni spremembi pred pH 6.
Lahko vam služi: amino skupina (NH2): struktura, lastnosti, primeriTočka enakovrednosti, kot je prikazana s slikam, je okoli 8,72 in ne 7. To je zato, ker CHO3COO- Anion je, da po hidrolizarju ustvari OH-, ki temelji na pH:
Pogl3COO- + H₂o ch3COOH +OH-
Obdobja
Titracija ocetne kisline z natrijevim hidroksidom lahko razdelimo na 4 stopnje za analizo.
- Preden začnemo dodajati bazo (NaOH), je pH raztopine kisel in je odvisen od disociacije ocetne kisline.
- Ko dodamo natrijev hidroksid, se tvori raztopina za dušenje acetata, vendar se na enak način poveča tvorba konjugirane acetatne podlage, kar s seboj prinaša povečanje raztopine raztopine raztopine.
- PH točke enakovrednosti se pojavi na pH 8,72, kar je odkrito alkalno.
Točka enakovrednosti nima konstantne vrednosti in se razlikuje glede na spojine, ki so vključene v stopnjo.
- Z nadaljnjim dodajanjem NaOH se po doseganju enakovrednosti pH poveča zaradi presežka natrijevega hidroksida.
Izbira kazalnikov glede na točko enakovrednosti
Fenolphtalein je koristen pri določanju enakovrednosti v tej stopnji, saj ima barvno točko v pH okoli 8, ki pade v pH območje titracije ocetne kisline, ki vključuje točkovno enakovrednost (pH = 8,72).
Po drugi strani metilna rdeča ni koristna pri določanju enakovrednosti, saj spreminja barvo v pH intervalu od 4,5 do 6,4.
Reference
- Čelada, Anne Marie. Opredelitev točke enakovrednosti. Opomogel od Thoughtco.com
- Razlika med končno točko in točko enakovrednosti. Pridobljeno iz razlike med.mreža
- Točka enakovrednosti: Opredelitev in izračun. Študija je bila obnovljena.com

